Trabajos del curso CTS
Sobre la investigación, desarrollo y producción pública de nuevos medicamentos
On research, development and public production of new drugs
Pesquisa, desenvolvimento e produção pública de novos medicamentos
Sobre la investigación, desarrollo y producción pública de nuevos medicamentos
Ciencia, Tecnología y Política, vol. 3, núm. 4, 2020
Universidad Nacional de La Plata
Recepción: 10 Marzo 2020
Aprobación: 04 Mayo 2020
Resumen: La industria farmacéutica ya no es hoy la gran industria innovadora, como lo fue en el siglo pasado. La investigación basada en medicamentos “yo también” y las prácticas de “reverdecimiento” son un claro ejemplo del abandono de ese sitial. Por otro lado, los Estados son quienes financian mayoritariamente las investigaciones que dan lugar a las pocas innovaciones radicales en materia de medicamentos. En este trabajo se discute esta problemática y cómo, dejar en manos de la industria farmacéutica privada las últimas etapas de investigación y desarrollo de nuevos medicamentos y su producción, ha permitido que las empresas involucradas prioricen sus beneficios económicos y la rentabilidad de sus accionistas, relegando la investigación y desarrollo en nuevos tratamientos que puedan resolver problemas de Salud Pública. Se discute además cómo la Producción Pública de Medicamentos y otras políticas podrían contribuir a un acceso universal y a resolver las necesidades sanitarias argentinas.
Palabras clave: producción pública de medicamentos, pseudoinnovación en industria farmacéutica, costos medicamentos, medicamentos me too.
Resumen: The pharmaceutical industry is no longer the great innovative industry today, as it was in the last century. The research based on “me too” drugs and the “greening” practices are a clear example of the abandonment of this place. On the other hand, it is the States that mainly finance the research that gives rise to the few radical innovations in the field of medicines. This work discusses this problem and how, leaving the last stages of research and development of new drugs and their production in the hands of the private pharmaceutical industry, has allowed the companies involved to prioritize their economic benefits and the profitability of their shareholders, relegating research and development in new treatments that can solve Public Health problems. It also discusses how the Public Production of Medicines and other policies could contribute to universal access and to solving Argentine health needs.
Palabras clave: producción pública de medicamentos, pseudoinnovación en industria farmacéutica, costos medicamentos, medicamentos me too.
Resumo: A indústria farmacêutica não é mais a grande indústria inovadora hoje, como era no século passado. A pesquisa baseada em drogas “eu também” e as práticas de “ecologização” são um exemplo claro do abandono desse local. Por outro lado, são os Estados que financiam principalmente a pesquisa que dá origem a poucas inovações radicais no campo dos medicamentos. Este trabalho discute esse problema e como deixar as últimas etapas de pesquisa e desenvolvimento de novos medicamentos e sua produção nas mãos da indústria farmacêutica privada permitiu às empresas envolvidas priorizar seus benefícios econômicos e a rentabilidade de seus acionistas, relegando pesquisa e desenvolvimento de novos tratamentos capazes de solucionar problemas de saúde pública. Ele também discute como a produção pública de medicamentos e outras políticas podem contribuir para o acesso universal e a solução das necessidades de saúde da Argentina.
Palavras-chave: produção pública de medicamentos, pseudo-inovação na indústria farmacêutica, custos de medicamentos, medicamentos me too.
Keywords: public drug production, pseudo-innovation in the pharmaceutical industry, drug costs, me too drugs
¿Qué tan innovadora es la industria farmacéutica privada?
En un informe publicado en Reino Unido a pedido del Partido Laborista, titulado “Democratic public ownership in the UK pharmaceutical sector”1 (en español: “Propiedad pública democrática en el sector farmacéutico británico”), se menciona que “la investigación financiada por los contribuyentes conduce a la obtención de nuevas tecnologías médicas que salvan vidas, las cuales luego son patentadas por el sector privado y se venden a altos precios, agotando los recursos del National Health Service” (NHS, Servicio Nacional de Salud) y que “el gobierno debería priorizar la búsqueda de un cambio sistemático, hacia un enfoque de la innovación médica impulsada por el Estado, de una manera más integral” (Brown et al., 2019). Esta situación ha sido también analizada por Mazzucato (2014) para el caso de EEUU, derribando el mito de que el sector privado ha sido innovador, dinámico y competitivo, mientras que el Estado ha desempeñado un rol más pasivo. Hoy es cada vez más aceptado que, en los últimos años, las innovaciones en el campo farmacéutico han sido pocas y, de éstas, la mayoría provienen de investigaciones que en etapas tempranas han sido financiadas principalmente con fondos públicos. De las nuevas entidades moleculares aprobadas en EEUU, entre 1993 y 2004, el 75% provienen de investigaciones financiadas por laboratorios de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) (Mazzucato, 2014). Sólo por mencionar algunos ejemplos: paclitaxel en tratamiento de primera línea de diferentes tipos de cánceres, eritropoyetina en las anemias, imatinib en algunos tipos de leucemias.
Otra cuestión abordada en el informe mencionado es la definición de las prioridades en investigación y desarrollo (I+D) de medicamentos. Se afirma que “en el actual sector farmacéutico, la innovación se orienta hacia las áreas donde pueden obtenerse mayores retornos, las cuales no siempre se corresponden con las necesidades de la Salud Pública. Las áreas que no son potenciales mercados en crecimiento son en gran parte ignoradas”. Prueba de esto es que los recursos que las compañías destinan a I+D en los últimos años se hayan centrado en el desarrollo de los denominados medicamentos “me too” o “yo también” (Angell, 2006; Mazzucato, 2014; Ugalde y Homedes, 2009), los cuales son estructuralmente similares a medicamentos ya conocidos, presentan mínimas diferencias farmacológicas, mecanismo de acción idéntico y muy escasa o nula ventaja terapéutica sobre sus congéneres más antiguos. Aún así, estos “nuevos” medicamentos “yo también”, pueden ser patentados como novedosos, promocionándolos como la mejor opción a prescribir y tendiendo a dejar en desuso las alternativas anteriormente utilizadas, que ya no cuentan con una patente vigente que garantice la exclusividad de producción.
En este modelo de pseudoinnovación, desde mediados de la década del ‘90, los vencimientos de patentes de muchos de los medicamentos más vendidos incentivaron a la industria farmacéutica a solicitar múltiples patentes secundarias (es decir, una nueva patente para un nuevo uso, dosificación, proceso o formulación), con el objetivo de impedir el ingreso de los denominados medicamentos genéricos al mercado, que pudieran competir con el original y evitar la caída en las acciones de estas compañías. Se perpetúa, así, el monopolio y la fijación de los precios de venta, denominándose a esta práctica “evergreening” o “reverdecimiento” (Song & Han, 2016).
Estos dos fenómenos mencionados han contribuido a una sostenida caída en la verdadera innovación terapéutica. En la revisión sistemática que todos los meses presenta la revista Prescrire sobre los nuevos medicamentos lanzados al mercado global, se encontró que, en 2016, de 92, sólo 15 representaban un avance terapéutico probado (Prescrire International, 2017). Como se muestra en la Tabla 12, no es algo particular del 2016, ya que el número de verdaderas innovaciones no se ha modificado demasiado en los últimos 10 años.
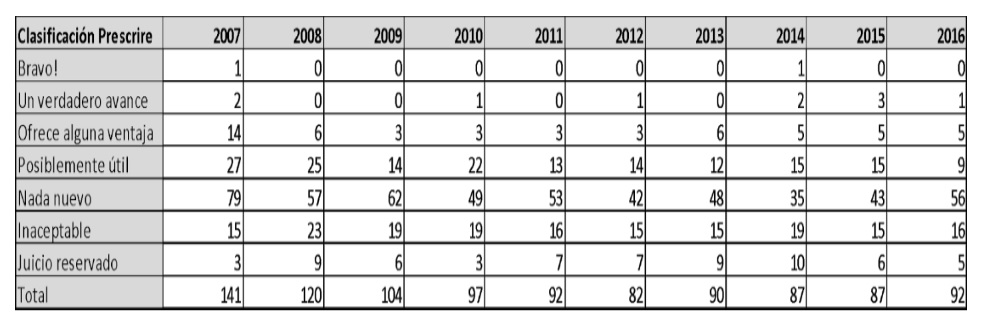
En forma análoga, sólo el 5,9% de los nuevos medicamentos patentados en Canadá entre 1990 y 2003 eran realmente innovadores (Morgan et al., 2005). Lo mismo ha sido descrito para EEUU: sólo el 23% de los fármacos aprobados entre 1998 y 2002 constituían alguna innovación (Angell, 2006).
Como es de esperar, Argentina no es ajena a la falta de innovación en su industria farmacéutica, ya que el mayor porcentaje de aprobación de nuevos medicamentos en el país lo representan aquellos ya comercializados en al menos uno de los países considerados de alta vigilancia sanitaria por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)3. En la práctica, por lo tanto, se reproduce en el país la dinámica del mercado farmacéutico internacional. Como prueba de esto, Cañás, Buschiazzo & Urtasun (2019) evaluaron la relevancia clínica de los medicamentos aprobados en Argentina (tanto de producción en el país como en el exterior) durante 2016 y concluyeron que, en el mejor de los casos, sólo 28% de los nuevos fármacos representaban un avance terapéutico significativo.
Si el cambio de paradigma hacia un modelo de pseudoinnovación está siendo problematizado en los países centrales, es razonable pensar que la situación se agrava aún más en los países periféricos, donde la epidemiología es diferente y donde se concentra la mayor parte de las enfermedades olvidadas4. Solo el 4% de los medicamentos aprobados, entre 2000 y 2011, por la Administración de Medicamentos y Alimentos de EEUU (FDA, por sus siglas en inglés) y la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) eran destinados al tratamiento de enfermedades que se dan en los países periféricos (Pedrique et al., 2013). Un ejemplo lo constituye la tuberculosis, la cual es padecida aproximadamente por 30.000 personas en Argentina. Sin embargo, la mayoría de los tuberculostáticos tienen la patente vencida hace años y éste no es un nicho que garantice márgenes de rentabilidad interesantes. De hecho, en 2016 tres licitaciones internacionales quedaron desiertas por falta de interés de los laboratorios. Las consecuencias fueron importantes faltantes en el abastecimiento, que debieron ser cubiertas con la Producción Pública de Medicamentos (PPM) (Alonso, 2017).
¿Cómo se fijan los precios de los medicamentos?
Generalmente se acepta que el alto precio al que se venden los medicamentos se debe a la recompensa que la industria percibe por la inversión realizada en la búsqueda de nuevas moléculas innovadoras. Sin embargo, como se analizó previamente, en los últimos años han sido pocos los medicamentos innovadores. Además, la mayor parte de las etapas tempranas de investigación en estos fármacos ha sido financiada con fondos públicos. No obstante, los precios no han dejado de aumentar. En EEUU, los precios de los veinte medicamentos más prescriptos durante el período 2012-2017 se han incrementado diez veces por encima del promedio de la inflación (CNN Health, 2018). En el Reino Unido, el gasto del NHS en medicamentos en 2015-2016 fue de £15,8 mil millones, cifra que ha experimentado un rápido crecimiento a partir de 2010 debido a la utilización de medicamentos nuevos y especializados (Baines, 2018). En Argentina, se observa una tendencia similar: el aumento de los precios de los medicamentos entre mayo de 2015 y mayo de 2019 alcanzó el 314%, con casos de medicamentos esenciales que incrementaron su precio en un 784% (Centro de Economía Política Argentina, 2019), mientras que la inflación general en ese mismo período fue aproximadamente del 256% (IPC/INDEC e IPC CABA/GCBA)5.
Es cierto que el precio no refleja solamente el costo de las materias primas, la manufactura y la comercialización, sino también el costo de la investigación previa de ese medicamento y de otros que no llegaron a ser comercializados (Laporte & Tognoni, 1993). El problema es que resulta difícil conocer el costo real que conlleva desarrollar un medicamento. Mientras que desde la industria se sostiene que es de aproximadamente u$s 2,500 millones en promedio (CAEMe, 2019), las investigaciones independientes afirman que el valor real está entre el 25 y el 50% de lo declarado por las farmacéuticas (Ugalde & Homedes, 2009).
Por otro lado, el presupuesto correspondiente a “comercialización y administración” de medicamentos, según la Comisión de Bolsa y Valores de EEUU, es al menos el doble de lo que se gasta en I+D (Angell, 2006), lo cual representa una gran caja negra, en la que se supone se engloban los gastos en actividades relacionadas a prácticas de lobby, publicidad de los productos disfrazada de enseñanza, pagos de viajes y/o obsequios a los/as médicos/as que prescriben sus productos, etc.
Un informe reciente de la Organización Mundial de la Salud (OMS) realizado sobre el sector oncológico, afirma que los precios no se relacionan con la inversión realizada para su I+D, sino que se establecen buscando el valor máximo que el financiador está dispuesto a pagar (World Health Organization, 2018). Esto se ve reflejado en que las compras de cada sistema de salud, o de cada institución, se negocian con valores muy diferentes. Es paradójica, en este sentido, la situación que se da en EEUU –único país desarrollado que no establece ningún control sobre los precios–, donde las conocidas “caravanas” de pacientes viajan hasta Canadá o México para adquirir los medicamentos a una décima parte de lo que pagan en su país (Kuchler, 2019).
Como respuesta a esta problemática, se pueden mencionar dos estrategias regionales que se establecieron para adquirir medicamentos a precios más convenientes. Por un lado, la creación, por parte de la Unión de Naciones Suramericanas (UNASUR), de un “banco de precios de medicamentos” en el año 2015, el cual buscó conocer efectivamente cuánto paga cada país por los medicamentos que adquiere, para establecer precios de referencia (Ministerio de Salud y Desarrollo Social, 2015). Por otro lado, la Organización Panamericana de la Salud (OPS) ha favorecido la creación del denominado “Fondo Estratégico” para la compra conjunta de medicamentos de alto costo, bajo la premisa de que al demandar un mayor volumen puede lograrse una negociación más ventajosa (OPS, s. f.).
Al analizar los precios, no puede perderse de vista la cuestión de las patentes y el mencionado proceso de “reverdecimiento”. Los sistemas de patentes y los derechos de propiedad intelectual se aplican mundialmente con el fin de constituir un fomento a la investigación, para lo cual, las oficinas de patentes de cada país premian el esfuerzo a la innovación al otorgar a la empresa que desarrolla un producto un monopolio legal temporal para comercializarlo, lo que le garantiza mantener a los competidores fuera del mercado. En lo que concierne a los medicamentos, existen dos formas de obtener la exclusividad de mercado. Por un lado, a través del sistema de patentes: aquellos productos farmacéuticos que cumplan con las características de ser útiles, nuevos y de uso no obvio, pueden solicitar una patente a las diferentes oficinas de propiedad intelectual en cada país. Por otro lado, a través de los derechos de comercialización que otorgan las agencias reguladoras al momento de la aprobación del medicamento, lo cual suele suceder bastante tiempo después de registrar la patente primaria. El sistema ha sido diseñado para que, cumplido el período de exclusividad, los competidores genéricos puedan ingresar al mercado, lo cual conlleva una reducción de los precios (Song & Han, 2016). Sin embargo, la realidad con los medicamentos suele estar bastante alejada de esta concepción teórica y la exclusividad comercial puede perpetuarse mediante la solicitud de patentes secundarias, previamente comentada (Feldman, 2018).
En el caso del informe publicado en el Reino Unido, que se menciona al comienzo de este artículo, para disminuir los costos de los medicamentos se propone la posibilidad de que el Estado tome la iniciativa en la producción, para así mejorar el acceso y garantizar la sustentabilidad del sistema de salud. Ésta se realizaría a través de la conformación de una oficina de PPM dentro del Departamento de Salud y Servicios Humanos.
Producción Pública de Medicamentos en Argentina para garantizar un acceso universal
Como ya se ha mencionado, mientras que Argentina continúe aprobando medicamentos que ya se encuentran comercializados en los países centrales mediante el decreto 150/92, seguirá dependiendo de cambios estructurales en estos países para reorientar el sistema hacia las necesidades de los/as usuarios/as. Estos cambios deberían darse principalmente en dos sentidos: Por un lado, las agencias que otorgan patentes deberían analizar las solicitudes de manera más exhaustiva y crítica para que cumplan con los requisitos de utilidad, innovación y no obviedad. Por otro lado, las agencias reguladoras deberían exigir que los ensayos clínicos presentados demuestren mayor eficacia o mejor margen de seguridad que los tratamientos ya aprobados, y no continuar aceptando comparaciones contra placebo, para evitar que continúen ingresando al mercado los medicamentos “yo también” y los desarrollados a través de las prácticas de “reverdecimiento”.
Sin embargo, Argentina también cuenta con diversas iniciativas que podrían contribuir para, en los términos expresados por Mario Testa, crear condiciones de posibilidad para desencadenar procesos que contribuyan a mejorar el acceso de la población a mejores medicamentos. Una de estas iniciativas es la Producción Pública de Medicamentos (PPM) que analizaremos a continuación.
La PPM a escala industrial es una estrategia que ha sido encarada por un puñado de países en el mundo, como Brasil, Tailandia, Cuba y China. Argentina posee en este ámbito una rica historia de más de un siglo, lo que la convierte en un caso interesante para el análisis (Santos & Thomas, 2018). Actualmente, cuenta con aproximadamente 40 laboratorios de PPM de diversa escala, distribuidos a lo largo y ancho del país. La creación, en el año 2014, de la Agencia Nacional de Laboratorios Públicos (ANLAP) como ente articulador del sistema apuntó a conferir las capacidades necesarias para conformar una red capaz de abastecer a los efectores del sistema público y garantizar soberanía en la investigación, desarrollo y producción de medicamentos.
En el marco de la PPM, los medicamentos son considerados bienes sociales en lugar de bienes de mercado, ya que son parte del derecho a la salud, por lo que la investigación, el desarrollo y la producción en este campo no pueden dejarse librados a las reglas del mercado. En efecto, la concepción de bien social permite que estos laboratorios sean proveedores del Estado a un valor promedio 50% menor al de los privados. Santa Fe, la provincia con la más sólida política de PPM, ha logrado ahorrar u$s 55 millones en los últimos tres años gracias a las compras realizadas a sus laboratorios públicos (El Litoral, 2019).
Por otra parte, la PPM permite al Estado conocer los “precios testigo”, es decir estimar cuál es la estructura de costos de producción de los medicamentos. Así, le brinda al Estado una mayor información para obtener un precio justo a la hora de negociar las adquisiciones con los privados. En caso de no llegar a un acuerdo, existe la posibilidad de encargar la producción a uno de los laboratorios públicos.
Además, la PPM es una herramienta fundamental para garantizar la soberanía nacional en materia sanitaria. Como ya se mencionó, los intereses de investigación, desarrollo y producción de la industria farmacéutica privada suelen no estar en línea con las necesidades de la salud pública, por lo que depender exclusivamente del sector privado no parece ser una buena alternativa. En este sentido, es paradigmático el ejemplo de la vacuna para tratar la Fiebre Hemorrágica Argentina (enfermedad endémica nacional), la cual es únicamente producida en el Instituto Nacional de Enfermedades Virales Humanas "Dr. Julio I. Maiztegui". Actualmente el país atraviesa una crisis en torno a la producción de esta vacuna, ya que la misma fue reducida durante 2018 y ha sido discontinuada durante el 2019, debido a la falta de fondos para reponer maquinaria averiada, poniéndose así en riesgo la provisión futura. En un escenario mundial en crisis, como el actual, una PPM con adecuado financiamiento permite hacer frente a patologías locales y asegurar la provisión de medicamentos más allá del escenario geopolítico global.
También, la PPM puede permitir una asociación virtuosa entre el mundo académico y el sector productivo, donde las necesidades de Salud Pública dialoguen con las líneas de investigación del sector científico-tecnológico. Se puede así consolidar una planificación global desde la investigación básica hasta el nivel de producción, pasando por las etapas de desarrollo y ensayos clínicos. Un ejemplo en este sentido lo representa el factor IX para el tratamiento de la Hemofilia B, producto biotecnológico desarrollado por el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba (Díaz de Guijarro, 2019) y que hasta ahora sólo era comercializado por unas pocas empresas farmacéuticas multinacionales (UNC, 2019). En este punto, podemos pensar que la PPM puede beneficiarse al incorporar elementos relativos al enfoque interdisciplinario propuesto por Rolando García (2006). Los subsistemas abarcados en el recorrido entre investigación farmacológica y consumo del medicamento por parte del paciente involucran muy diversas disciplinas (química farmacéutica, farmacotecnia, economía, sociología, psicología, etc). Si a esto se suma su mutua dependencia, indispensable para el análisis integral, se podría postular a la PPM como una totalidad organizada6 en palabras de García.
Por otro lado, la PPM resulta relevante para la economía nacional en cuanto permite disminuir las importaciones de productos elaborados. En Argentina, el sector farmacéutico presenta un balance comercial deficitario, que se ha profundizado en los últimos años, representando u$s 2.171,6 millones en 2017 (Garfinkel, 2018). El principal motivo de este déficit se debe a importaciones de productos provenientes de firmas multinacionales y de materias primas para la industria nacional. La PPM favorece el reemplazo de estos medicamentos, a la vez que tiene el potencial para profundizar la articulación del desarrollo y producción de materias primas con el sector científico-tecnológico. Al mismo tiempo que se nutre de equipamiento proveniente de la industria metalmecánica nacional, impulsando virtuosos encadenamientos productivos.
Comentarios finales
La industria farmacéutica ya no es hoy la gran industria innovadora, como lo fue en el siglo pasado. La investigación basada en medicamentos “yo también” y las prácticas de “reverdecimiento” son un claro ejemplo del abandono de ese sitial. Por otro lado, los Estados son quienes financian mayoritariamente las investigaciones “básicas” que dan lugar a las pocas innovaciones radicales en materia de medicamentos.
Tal como se ha mostrado en este trabajo, dejar en manos de la industria farmacéutica privada las últimas etapas de investigación y desarrollo de nuevos medicamentos y su producción, ha permitido que las empresas involucradas prioricen sus beneficios económicos y la rentabilidad de sus accionistas, relegando la investigación y desarrollo de nuevos tratamientos que puedan resolver problemas de Salud Pública.
El hecho de que en los países centrales se intente poner en agenda un mayor control público sobre la industria farmacéutica resulta de interés para repensar estrategias aplicables al caso argentino. Como ha quedado de manifiesto, existen diferentes herramientas en materia de política sanitaria y producción de medicamentos, como la PPM, que podrían contribuir al acceso universal y al beneficio de los/as usuarios/as. El desafío de apostar a la PPM no es sólo científico sino también político, y la prioridad deberá centrarse en poner en el eje del debate los intereses y actores, que son muchos y bien conocidos.
Referencias
Alonso, M. (2017). Tuberculosis: Medicamentos públicos al rescate. TSS. Universidad Nacional de San Martín. Recuperado de https://bit.ly/38gS8lB
Angell, M. (2006). La verdad acerca de la industria farmacéutica. Cómo nos engaña y qué hacer al respecto. Bogotá (Colombia): Editorial Norma.
Baines, D. (2018). High-Cost Medicines in England. En Equitable Access to High-Cost Pharmaceuticals (pp. 23-34).
Brown, D.; Chow, H.; Hanna, T. & McDonald, D. (2019). Democratic public ownership in the UK pharmaceutical sector. Working paper. Recuperado de https://bit.ly/2OJxenx
CAEMe (2019). ¿Cuánto cuesta producir un nuevo medicamento? Cámara Argentina de Especialidades Medicinales. Recuperado de https://bit.ly/38eEwHy
Centro de Economía Política Argentina (2019). El impacto inflacionario en los medicamentos—Junio de 2019. Recuperado de https://bit.ly/31G7RYW
CNN Health. (2018). Medicare drug prices soar at 10 times rate of inflation, report says. Recuperado de: https://cnn.it/2xChfCl
Díaz de Guijarro, E. (2019). Laboratorio de Hemoderivados de Córdoba. Ciencia, tecnología y política, 2(3), 030. https://doi.org/10.24215/26183188e030
El Litoral (18 de agosto de 2019). En 3 años, la producción del LIF permitió un ahorro de U$D 55 millones al Estado. Recuperado de https://bit.ly/2SfqdwT
Feldman, R. (2018). May your drug price be evergreen. Journal of Law and the Biosciences, 5(3), 590-647.
García, R. (2006). Sistemas complejos: Conceptos, métodos y fundamentación epistemológica de la investigación interdisciplinaria. Gedisa.
Garfinkel, F. (2018). Informes de Cadenas de Valor “Industria farmacéutica”. Ministerio de Hacienda, Presidencia de la Nación Argentina. Recuperado de https://bit.ly/2OIqiqK
Kuchler, H. (19 de septiembre de 2019). Why prescription drugs cost so much more in America. Financial Times. Recuperado de https://on.ft.com/2uDDKFB
Laporte, J.R. & Tognoni, G. (1993). Principios de epidemiología del medicamento (2° Edición). Masson-Salvat.
Mazzucato, M. (2014). El Estado emprendedor: mitos del sector público frente al privado. Barcelona: RBA.
Ministerio de Salud y Desarrollo Social (28 de agosto de 2015). Ponen en marcha proyecto para la creación del Banco de Precios para Medicamentos de la UNASUR. Recuperado de: https://bit.ly/35Awfxm
Morgan, S.; Bassett, K.; Wright, J.; Evans, R.; Barer, M.; Caetano, P. & Black, C. (2005) “Breakthrough” drugs and growth in expenditure on prescription drugs in Canada. British Medical Journal, 331: 815.
Organización Panamericana de la Salud. (s. f.). Fondo Estratégico de la OPS. Recuperado de https://bit.ly/3fpDnRm
Pedrique, B.; Strub-Wourgaft, N.; Some, C.; Olliaro, P.; Trouiller, P.; Ford, N. & Bradol, J.H. (2013). The drug and vaccine landscape for neglected diseases (2000–11): A systematic assessment. The Lancet Global Health, 1(6), e371-e379.
Prescrire International (2017). New products and new indications in 2016: A system that favours imitation over the pursuit of real progress. Prescrire International, 26(182),136-139.
Prescrire (2018). Prescrire’s ratings system: new drugs and indications, at a glance. Recuperado de: https://bit.ly/3eJW2HA
Santos, G. & Thomas, H. (2018). Producción pública de medicamentos. Ciencia, tecnología y política, 1(1), 007. https://doi.org/10.24215/26183188e007
Song, C.H. & Han, J.W. (2016). Patent cliff and strategic switch: Exploring strategic design possibilities in the pharmaceutical industry. SpringerPlus, 5(1).
Ugalde, A. & Homedes, N. (2009). Medicamentos para lucrar. La transformación de la industria farmacéutica. Salud Colectiva, 5(3), 305-322.
Universidad Nacional de Córdoba. (2019). Hemoderivados desarrolla su primer medicamento por ingeniería genética. Recuperado de: https://bit.ly/2W55BsZ
World Health Organization (2018). Pricing of cancer medicines and its impacts. Recuperado de https://bit.ly/38jcoDo
Notas