Revisión bibliográfica
Métodos contraceptivos en gatas: pasado, presente y futuro
Contraceptive methods in queens: past, present, and future
ANALECTA VETERINARIA
Universidad Nacional de La Plata, Argentina
ISSN: 1514-2590
Periodicidad: Semestral
vol. 42, e065, 2022
Recepción: 08 Febrero 2021
Revisado: 05 Abril 2022
Aprobación: 20 Mayo 2022

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Resumen: El control reproductivo temporal y no quirúrgico en gatas es fundamental para evitar camadas no deseadas y, de esta manera, disminuir la sobrepoblación y sus consecuencias negativas. Con este fin se han estudiado varias drogas, entre las cuales se encuentran progestágenos, andrógenos, melatonina, análogos de la GnRH y vacunas contraceptivas. Algunas de ellas han mostrado efectividad, aunque en determinados casos la duración del efecto contraceptivo no es predecible. Además, no están exentas de producir efectos adversos. En este trabajo se realiza una revisión sobre métodos contraceptivos en gatas, desde el comienzo de su utilización. El mismo reúne información relevante acerca de su utilidad, así como de la complejidad de la contracepción en esta especie, lo cual plantea la necesidad de encontrar alternativas que sean efectivas, seguras y predecibles.
Palabras clave: contracepción, gata, supresión del estro, control reproductivo.
Abstract: Temporary non-surgical reproductive control in queens is essential to avoid unwanted litter and therefore, reduce overpopulation and its negative consequences. Several drugs have been studied to this end, including progestins, androgens, melatonin, GnRH analogs, and contraceptive vaccines. Some of them have shown good results, although in certain cases the duration of the contraceptive effect is not predictable. In addition, these drugs are not exempt from causing adverse effects. In this work, a review of contraceptive methods in queens from the beginning of their use is carried out. This review provides relevant information about the usefulness as well as the complexity of contraception in queens, which raises the need to find alternatives that are effective, safe, and predictable.
Keywords: contraception, queen, estrous suppression, reproductive control.
Introducción
Debido a su capacidad de adaptación a diferentes entornos, los gatos son una especie muy prolífica. Por esta razón, el adecuado control reproductivo es importante para evitar la sobrepoblación felina, preservar la salud pública y mejorar el bienestar, tanto de las personas, como de los gatos y otros animales. Además, en ciertas zonas constituyen una especie invasora, que actúa como depredador de otras especies. En Nueva Zelanda y Australia los gatos están implicados en la extinción de varias especies de aves, mamíferos y reptiles. Por ello, el hecho de prevenir la reproducción mediante métodos quirúrgicos o no quirúrgicos es fundamental en el control de poblaciones felinas (Doherty et al., 2017; Sparkes et al., 2013; Veitch, 2001).
La castración quirúrgica es el principal método para el control de la reproducción en gatos. Este método es definitivo y evita la reproducción junto con las manifestaciones propias del estro no deseadas por los responsables de las mascotas. Si se realiza antes del primer estro, previene el desarrollo de neoplasias mamarias. Este procedimiento es rápido y seguro, aunque es costoso y no está ampliamente disponible, lo que dificulta su utilización en forma masiva (Welsh, 2018). Por el contrario, la contracepción mediante drogas anticonceptivas es reversible y menos costosa que la cirugía, lo que hace de ella un método adecuado para el control reproductivo de gatos callejeros y ferales. Además, es de utilidad cuando se desea el control temporal de la reproducción, como en el caso de planteles reproductivos o cuando los responsables de las mascotas rehúsan los procedimientos quirúrgicos. Asimismo, algunas drogas anticonceptivas producen graves efectos adversos, por lo que se requieren métodos efectivos y seguros que eviten la reproducción no deseada (Murray et al., 2015; Root Kustritz, 2018).
Los principales métodos contraceptivos incluyen la utilización de hormonas y vacunas. Los métodos hormonales han sido los más utilizados; sin embargo, muchos de ellos presentan graves efectos adversos, como es el caso de los progestágenos (Romagnoli, 2015). Otras hormonas, como los análogos de la hormona liberadora de gonadotropina (GnRH) y la melatonina, requieren ser administradas mediante implantes de liberación lenta, siendo variable la duración de su efecto (Gimenez et al., 2009; Munson et al., 2001; Rubion & Driancourt, 2009). Por otra parte, el uso de vacunas anticonceptivas, para ser efectivo, puede requerir más de una dosis; no obstante, el inicio y la duración de su efecto no es predecible (Fischer et al., 2018; Levy et al.,2011).
Progestágenos
Los progestágenos son derivados sintéticos de la progesterona y producen el mismo efecto biológico que la progesterona endógena. La alta concentración de progestágenos séricos ocasiona retroalimentación negativa sobre el hipotálamo y la hipófisis. De esta forma se inhibe la producción de las hormonas folículo estimulante (FSH) y luteinizante (LH), con la consiguiente supresión de la gametogénesis. Además, impiden el movimiento de los gametos hacia el sitio de fertilización e interfieren con la implantación (Asa, 2018; Romagnoli, 2015).
La efectividad de los progestágenos como método contraceptivo ha sido ampliamente estudiada. Asimismo, se han comunicado los riesgos debido a su utilización en felinos. Los efectos colaterales observados son hiperplasia endometrial quística, piometra, fibroadenomatosis mamaria, tumores mamarios, diabetes, supresión adrenocortical, pérdida de pelo y xantomatosis (Greenberg et al., 2013; Loretti et al., 2005; Munson, 2006).
| Progestágeno | Dosis | Eficacia y comentarios | Referencias | |
| Delmadinona | 0,25-0,7 mg/kg/semana, O* | Previno durante un año y el efecto comenzó a los 14 días de tratamiento | Gerber et al., 1973 | |
| Delmadinona | 2,5-5,0 mg/kg, 2 veces al año, SC | Previno hasta por un año y el efecto comenzó a los 14 días de tratamiento | Gerber et al., 1973 | |
| Clormadinona | Gatas inmaduras: 2 mg/semana, O | El efecto duró, al menos, dos años | Sawada et al., 1992 | |
| Clormadinona | Gatas adultas: 2-6,25 mg/semana, O | El efecto duró, al menos, un año | Sawada et al., 1992 | |
| Clormadinona | Implantes de: 2,5 mg/kg, 5 mg/kg, y 20 mg/kg, SC | Para cada uno de los implantes el efecto duró 12 meses. Los implantes fueron retirados un año después de su aplicación | Murakoshi et al., 1996 | |
| Levonorgestrel | 1 implante de 16 mg, SC | El efecto duró un año. Los implantes fueron retirados un año después de su aplicación. Tres de cuatro gatas presentaron estro y concibieron dentro de los siguientes 54 días | Baldwin et al., 1994 | |
| Levonorgestrel | Seis implantes de 36 mg, SC Tres implantes de 36 mg, SC | Los implantes se retiraron a los 30 días de su aplicación y luego de 11 a 79 días las gatas volvieron a ciclar No fueron efectivos en todas las gatas | Pelican et al., 2005 | |
| Levonorgestrel (en una matriz irradiada con cesio) | 40 mg/kg, SC y repetición a los 68 días, SC | El efecto duró, al menos, 36 semanas. Se observó malestar y vocalización durante la aplicación. Existió reacción local, dolor y enrojecimiento de las orejas | Looper et al., 2001 | |
| Levonorgestrel + etinilestradiol | 1 tableta (compuesta por 0,15 mg de levonorgestrel y 0,03 mg de etinilestradiol) por día, O | Falló en prevenir e incrementó los ciclos | Sarchahi et al., 2008 | |
| Megestrol | 5 mg/gata/semana, O | El efecto duró 70 días | Burke, 1982 | |
| Megestrol | Interestro: 25 mg, SC | El efecto duró 3,33 ±1,01 meses | Findik et al., 1999 | |
| Megestrol | Proestro: 5 mg/gata/día durante 4 días, luego cada 2 semanas, O Anestro: 5 mg/gata cada 2 semanas o 2,5 mg/gata semanalmente, O | Romagnoli & Sontas, 2010 | ||
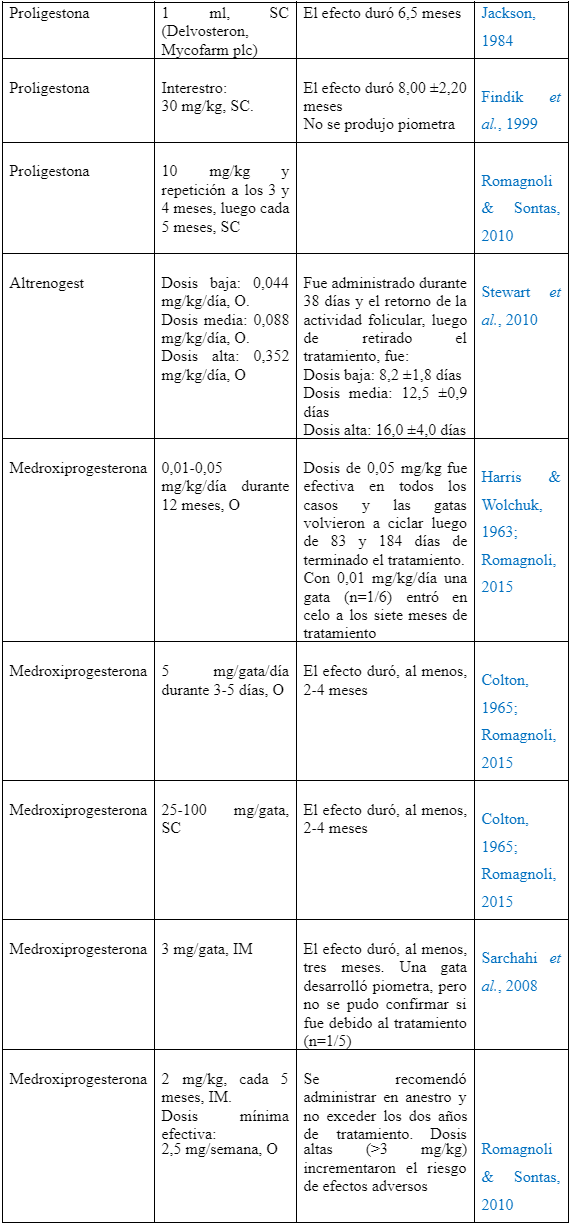
| Proligestona | 1 ml, SC (Delvosteron, Mycofarm plc) | El efecto duró 6,5 meses | Jackson, 1984 | |
| Proligestona | Interestro: 30 mg/kg, SC | El efecto duró 8,00 ±2,20 meses No se produjo piometra | Findik et al., 1999 | |
| Proligestona | 10 mg/kg y repetición a los 3 y 4 meses, luego cada 5 meses, SC | Romagnoli & Sontas, 2010 | ||
| Altrenogest | Dosis baja: 0,044 mg/kg/día, O. Dosis media: 0,088 mg/kg/día, O. Dosis alta: 0,352 mg/kg/día, O | Fue administrado durante 38 días y el retorno de la actividad folicular, luego de retirado el tratamiento, fue: Dosis baja: 8,2 ±1,8 días Dosis media: 12,5 ±0,9 días Dosis alta: 16,0 ±4,0 días | Stewart et al., 2010 | |
| Medroxiprogesterona | 0,01-0,05 mg/kg/día durante 12 meses, O | Dosis de 0,05 mg/kg fue efectiva en todos los casos y las gatas volvieron a ciclar luego de 83 y 184 días de terminado el tratamiento. Con 0,01 mg/kg/día una gata (n=1/6) entró en celo a los siete meses de tratamiento | Harris & Wolchuk, 1963; Romagnoli, 2015 | |
| Medroxi progesterona | 5 mg/gata/día durante 3-5 días, O | El efecto duró, al menos, 2-4 meses | Colton, 1965;Romagnoli, 2015 | |
| Medroxi progesterona | 25-100 mg/gata, SC | El efecto duró, al menos, 2-4 meses | Colton, 1965; Romagnoli, 2015 | |
| Medroxi progesterona | 3 mg/gata, IM | El efecto duró, al menos, tres meses. Una gata desarrolló piometra, pero no se pudo confirmar si fue debido al tratamiento (n=1/5) | Sarchahi et al., 2008 | |
| Medroxi progesterona | 2 mg/kg, cada 5 meses, IM. Dosis mínima efectiva: 2,5 mg/semana, O | Se recomendó administrar en anestro y no exceder los dos años de tratamiento. Dosis altas (>3 mg/kg) incrementaron el riesgo de efectos adversos | Romagnoli & Sontas, 2010 | |
El primer progestágeno en ser estudiado fue el acetato de delmadinona, el cual, administrado por vía oral o subcutánea, previno y suprimió el estro, sin producir efectos secundarios (Gerber et al., 1973; Jöchle & Jöchle, 1975).
Estudios posteriores sobre el acetato de clormadinona demostraron su efectividad para prevenir la gestación y suprimir el estro, mediante la administración oral o por medio de implantes subcutáneos (Tablas 1 y 2). Sin embargo, el principal efecto adverso comunicado fue una ligera ganancia de peso en el primer año de tratamiento. Además, se observaron afecciones mamarias y uterinas luego de 4,6 años de su administración (Jöchle & Jöchle, 1975; Murakoshi et al., 1996; Sawada et al., 1992; Tamada et al., 2003).
| Progestágeno | Dosis | Eficacia y comentarios | Referencias |
| Delmadinona | 0,5-1,0 mg/kg/día durante 6 días, O* | Disminuyó la atracción de los machos, el efecto comenzó a los 2-3 días de tratamiento | Gerber et al., 1973 |
| Delmadinona | 2,5-6,75 mg/kg una o dos veces al día, SC | Disminuyó la atracción de los machos, el efecto comenzó un día de tratamiento | Gerber et al., 1973 |
| Clormadinona | Dosis inicial: 25 mg O y luego 2 mg/semana, O. Dosis inicial: 12,5 mg, O, luego 12,5 mg/semana, O | Ambas dosis permitieron suprimir el estro dentro de las 72 horas de iniciado el tratamiento y el efecto duró, al menos, un año | Sawada et al., 1992 |
| Megestrol | 5 mg/gata durante 3 días, luego una vez por semana, O | Se suprimió el estro durante el tratamiento (10 semanas) | Burke, 1982 |
| Megestrol | 5 mg/día hasta que los signos del estro desaparezcan, luego 2,5 mg/día hasta 60 días, O | Burke, 1982 |
Posteriormente se realizaron investigaciones con implantes de levonorgestrel, logrando prevenir el estro (Tabla 1). Sin embargo, la necesidad de anestesia general para colocar una gran cantidad de implantes subcutáneos, junto al malestar y las reacciones locales que estos ocasionan, ha generado que sean poco prácticos para su utilización en esta especie. Una alternativa sería el desarrollo de implantes de mayor concentración, con el fin de reducir la cantidad necesaria de los mismos y así evitar el uso de anestesia general (Baldwin et al., 1994; Looper et al., 2001; Pelican et al., 2005). Otros estudios utilizaron presentaciones anticonceptivas de uso humano, las cuales combinan el levonorgestrel con etinilestradiol. Las mismas, administradas semanalmente por vía oral, no lograron prevenir el estro en las gatas. Por el contrario, se observó incremento en la frecuencia de los ciclos, posiblemente debido a la combinación de ambas drogas (Tabla 1) (Sarchahi et al., 2008).
Otro progestágeno utilizado ha sido el acetato de megestrol. Con el fin de suprimir y prevenir el estro durante cortos periodos se han estudiado diversos protocolos de administración por vía oral (Tablas 1 y 2) (Burke, 1982; Kutzler & Wood, 2006; Romagnoli, 2015). Asimismo, su aplicación subcutánea logró prevenir y suprimir el estro durante corto tiempo. No obstante, uno de los principales efectos adversos fue la ocurrencia de piometra en algunos de los animales tratados, lo cual mostró estar en relación con la dosis utilizada (Findik et al., 1999).
El acetato de medroxiprogesterona es un progestágeno que ha sido utilizado durante muchos años en la clínica veterinaria para la contracepción en gatas, mediante la administración oral o parenteral. Según los estudios realizados se recomienda administrarlo durante el anestro y durante no más de 2 años. Además, cuando se utilizan dosis mayores a 3 mg/kg se incrementa el riesgo de efectos adversos (Colton, 1965; Romagnoli & Sontas, 2010). Los efectos adversos observados fueron hiperplasia fibroepitelial mamaria, complejo hiperplasia endometrial quística, piometra y tumores mamarios (Keskin et al., 2009; Loretti et al., 2005; Sarchahi et al., 2008). Se ha comunicado la presentación de tumores mamarios al administrar medroxiprogesterona cada 3 meses, durante 5 años (Hernandez et al., 1975). De igual forma se observó el desarrollo de tumores luego de 9 y 10 años de administración regular (Keskin et al., 2009; Ochota et al., 2014). Si bien se ha alertado enfáticamente sobre los efectos adversos de la medroxiprogesterona en gatas, e incluso su contraindicación en esta especie, estos están relacionados con la utilización de dosis altas. Durante los primeros estudios realizados se logró suprimir el estro utilizando dosis bajas (0,01-0,05 mg/kg) por vía oral cada 24 horas, de modo que estas cantidades podrían ser consideradas de utilidad (Harris & Wolchuk, 1963; Romagnoli, 2015).
Otro progestágeno ampliamente estudiado ha sido la proligestona. Se han realizado estudios utilizando diversos protocolos de administración, tanto para prevenir como para suprimir el estro (Tabla 1) (Jackson, 1984; Romagnoli & Sontas, 2010). Findik et al. (1999) comunicaron que las gatas tratadas no presentaron efectos adversos tras la administración de proligestona. Sin embargo, Vitásek & Dendisová (2006) describieron un caso de hiperplasia fibroepitelial mamaria en una gata cuatro semanas luego de la administración de proligestona. Por otra parte, la administración oral de altrenogest ha demostrado suprimir la actividad ovárica a corto plazo, sin presentar efectos adversos. Sin embargo, requiere ser administrada diariamente para lograr su efecto, lo cual dificulta su utilización (Stewart et al., 2010).
Durante varios años los progestágenos han sido utilizados para el control de la reproducción felina. Si bien son efectivos para suprimir el ciclo estral, su utilización prolongada debe ser evitada debido a los efectos colaterales adversos que genera en las gatas. La permanencia de estos fármacos en la clínica reproductiva posiblemente se deba a que los métodos actuales no son totalmente predecibles; algunos de ellos son costosos y no están disponibles en todos países para su uso en Medicina Veterinaria. Por lo expuesto, continúan los estudios en busca de una opción farmacológica para el control de la reproducción, que brinde un adecuado efecto y seguridad.
Andrógenos
Los andrógenos son hormonas que interfieren con la fertilidad mediante retroalimentación negativa sobre la LH (Asa, 2018; Burke, 1976). Se ha comunicado que la administración diaria de mibolerona (50 µg/gata) previene el estro. Sin embargo, dosis inferiores (20 µg/gata/día) o la administración semanal (50 µg/gata) no tuvo efecto contraceptivo. Las gatas tratadas presentaron aumento del tamaño del clítoris, disfunción tiroidea y engrosamiento de la dermis cervical (Burke et al., 1977). Posteriormente se comunicó que la administración de 120 µg/gata/día produjo mortalidad debido a la hepatotoxicidad generada por este fármaco, por lo que no se aconseja su utilización en esta especie (Burke, 1982).
Otro andrógeno estudiado fue la metiltestosterona; no obstante, con la administración semanal por vía oral (12,5 mg/gata) durante tres meses no se logró prevenir el estro (Sarchahi et al., 2008). Debido a los efectos colaterales adversos y a su baja eficacia, los andrógenosno han resultado de utilidad para el control de la reproducción en gatas.
Melatonina
La melatonina es una hormona que regula la reproducción en los mamíferos que presentan estacionalidad reproductiva, es sintetizada en la glándula pineal y su regulación está dada por la exposición a la luz. De esta forma, durante la noche se secretan grandes cantidades de esta hormona (Pandi-Perumal et al., 2006).
En gatas, la exposición a largos periodos de luz disminuye los niveles de melatonina, lo cual desencadena la foliculogénesis. Por el contrario, durante los periodos de oscuridad ocurre una disminución de la actividad sexual, junto al incremento en los niveles de melatonina (García Mitacek, 2016; Leyva et al., 1984, 1989). Puede replicarse este efecto mediante la administración exógena de melatonina, lo que ocasiona supresión del ciclo estral. Esto puede ser de utilidad en casos en los que se requiera la interrupción temporal del ciclo estral, preservando el potencial reproductivo de las gatas (Faya et al., 2011; Gimenez et al., 2009; Goericke-Pesch, 2010; Graham et al., 2004).
Se ha comunicado que la administración de 30 mg diarios de melatonina por vía oral, tres horas antes del inicio de la oscuridad durante 35 días, inhibió la actividad ovárica durante 21 a 40 días luego de finalizado el tratamiento (Graham et al., 2004). Sin embargo, este régimen de administración hace que su aplicación sea poco práctica. Asimismo, se han realizado trabajos en los cuales se aplicaron implantes subcutáneos de 18 mg de melatonina con los que se logró prolongar la duración del interestro hasta 113 días cuando fue aplicado en el interestro, mientras que la duración fue de 61 días cuando se aplicó durante el estro. Por lo tanto, la duración de su efecto depende de la etapa del ciclo estral en el cual es aplicado (Gimenez et al., 2009).
Además, los implantes de melatonina han mostrado ser efectivos al prolongar la temporada no reproductiva en gatas (Gulyuz et al., 2009). Faya et al. (2011) observaron que el tratamiento con melatonina no retrasa la pubertad pero suprime el estro, en promedio, durante 63 días, tanto si es administrado por vía oral como mediante implantes subcutáneos. Posteriormente, en una encuesta realizada en Francia a criadores de gatos, se comunicó que la duración del efecto de los implantes de melatonina fue de 86,5±50,3 días, con un rango de 21-277 días, sin observar efectos adversos (Furthner et al., 2020).
Agonistas y antagonistas de la GnRH
La GnRH es un decapéptido sintetizado por el hipotálamo que actúa en la hipófisis, estimulando a las células gonadotropas a liberar LH y FSH para que se lleve a cabo la gametogénesis. No obstante, la continua estimulación ocasiona desensibilización de las células gonadotropas, lo que suprime la producción de LH y FSH (Conn & Crowley, 1991). Debido a este efecto, los agonistas de la GnRH son de utilidad como método contraceptivo. Sin embargo, previo al inicio de su efecto inducen el estro. Si bien las hembras pueden quedar preñadas, la gestación se pierde, ya que el cuerpo lúteo sufre involución temprana. Sin embargo, se observan signos de estro y atracción a los machos con las consecuentes molestias que esto produce al responsable de la mascota. Debido a esto las hembras deben ser separadas del macho durante 3 o 4 semanas (Asa, 2018; Drost & Thatcher, 1992).
Por el contrario, los antagonistas de la GnRH tienen la capacidad de bloquear de forma competitiva sus receptores en la hipófisis, lo que suprime la liberación de gonadotropinas. El efecto obtenido mediante este mecanismo es inmediato y, a diferencia de los agonistas de la GnRH, no ocasionan incremento en la secreción de gonadotropinas. La principal limitación para su uso es la dificultad de lograr presentaciones de liberación prolongada (Conn & Crowley, 1991; Gobello, 2012; Herbst, 2003).
El análogo de la GnRH más utilizado es la deslorelina, con una actividad biológica de entre 10 y 140 veces superior al de la GnRH (Padula, 2005). Para obtener su efecto contraceptivo se aplican implantes de liberación lenta (4,7 mg) por vía subcutánea. Como en el caso de los demás agonistas de la GnRH, luego de su aplicación se observa inducción temporal del estro (Munson et al., 2001). La administración conjunta de acetato de megestrol permite evitar el incremento inicial en los niveles de estrógenos (Toydemir et al., 2012). Se ha comunicado que en hembras prepúberes suprime la función reproductiva, por lo menos, durante 48 semanas (Mehl et al., 2017) y hasta 21-36 meses (Cecchetto et al., 2017). La principal desventaja de la deslorelina es la variable duración del efecto. Se ha comunicado la ocurrencia de celos entre 16 y 37 meses (Goericke-Pesch et al., 2013) y entre 8 y 38 meses (Furthner et al., 2020) luego de la colocación del implante. Este hecho puede estar influenciado por la cantidad de horas luz a la cual están expuestas las gatas al momento de la administración. Esto dificulta establecer el momento ideal para volver a aplicar el implante en el caso de requerir continuar su uso como método contraceptivo (Fontaine, 2015; Toydemir et al., 2012). Por lo general, tras su utilización no se producen efectos adversos relevantes, aunque pueden llegar a observarse ganancia de peso, prurito y edema local (Furthner et al., 2020; Goericke-Pesch et al., 2013; Munson et al., 2001). En síntesis, se considera un método seguro y eficiente, con la ventaja de que su aplicación es bien tolerada y no requiere anestesia.
Otro análogo de la GnRH es la nafarelina. Su aplicación subcutánea mediante implantes (azagly-nafarelina) previno la ovulación hasta 3 años. El uso de los mismos no causó reacciones locales, aunque algunos se desplazaron del lugar de inserción, lo cual dificultó su extracción (Rubion & Driancourt, 2009).
En el caso de los antagonistas de la GnRH, la acilina, administrada durante el proestro (330 µg/kg), no afectó la duración del estro, aunque previno la ovulación (Risso et al., 2010). Otro antagonista de la GnRH (antide) presentó efectividad variable sobre la actividad ovárica en gatas (Pelican et al., 2005, 2008). Al parecer, este antagonista de la GnRH no tiene la misma eficacia que en otras especies animales, en las que se ha registrado una actividad luteolítica.
Los agonistas y antagonistas de la GnRH han mostrado ser seguros y efectivos. El desarrollo y estudio de nuevos antagonistas de la GnRH es una alternativa a tener cuenta, debido a que su mecanismo de acción presenta ventajas frente a los agonistas de la GnRH.
Inmunocontracepción
Las vacunas contraceptivas que han tenido mayor éxito en diferentes especies animales son las anti-GnRH y las elaboradas con la zona pelúcida de ovocitos. Las vacunas anti-GnRH interfieren en la secreción de gonadotropinas, suprimiendo así la producción de gametos; las mismas han demostrado efectividad, tanto en machos como en hembras. En cambio, las vacunas en las que se utiliza la zona pelúcida de ovocitos están orientadas a interferir en la funcionalidad de los gametos y se han utilizado para el control poblacional de varias especies de mamíferos (Naz, 2011).
Para controlar la población de animales callejeros, las vacunas deben generar inmunidad durante mucho tiempo sin requerir la aplicación de refuerzos; además, deben ser de bajo costo y fácil aplicación (Purswell & Kolster, 2006).
Las vacunas elaboradas con la zona pelúcida han tenido poco efecto en gatas. Por el contrario, las vacunas anti-GnRH han demostrado mayor efectividad en esta especie y tienen como ventaja que, además de evitar la preñez, suprimen el comportamiento indeseable originado por las hormonas sexuales (Levy, 2011).
Vacunas orientadas hacia la zona pelúcida
La zona pelúcida es una capa acelular de glicoproteínas que envuelve al ovocito y es importante para la unión del mismo con el espermatozoide. Las vacunas orientadas hacia esta zona producen infertilidad al interferir con la interacción entre los gametos. Aquellas elaboradas con zona pelúcida porcina han demostrado ser efectivas en varias especies animales. Ivanova et al. (1995) describieron el potencial contraceptivo del uso de proteínas de la zona pelúcida porcina en gatas. Sin embargo, se observó que los anticuerpos formados mostraban pobre reacción cruzada y no se unían a la zona pelúcida felina (Eade et al., 2009; Gorman et al., 2002). Por ello se realizaron estudios con fuentes de zona pelúcida de otras especies (perra, vaca, visón, hurón y gata). Sin embargo, estas vacunas solo indujeron la formación de anticuerpos contra la zona pelúcida de sus respectivas especies, sin producir anticuerpos contra la zona pelúcida felina, lo que ocasionó preñez de todas las gatas vacunadas (Levy et al., 2005). Asimismo, se ha observado que la aplicación de vacunas elaboradas con zona pelúcida y que contienen adyuvante de Freund producen hipercalcemia, además de edema, extensa lesión muscular y fibrosarcoma en el sitio de aplicación (Munson et al., 2005). De la misma forma, vacunas de ADN con subunidades proteicas de zona pelúcida felina provocaron la formación de bajos niveles de anticuerpos (Eade et al., 2009). Por lo tanto, estas vacunas no son de utilidad en gatas.
Vacunas de receptor de LH
Las vacunas de receptor de LH bloquean la unión de la LH y de la gonadotropina coriónica con su receptor en el ovario, debido a los anticuerpos generados por la inmunización activa.
Saxena et al. (2003) comunicaron los resultados de experiencias en las que se colocaron implantes subcutáneos que contenían receptor de LH (5 mg), seguidos de otros cuatro refuerzos de receptor de LH (0,1 mg) por vía intramuscular a los 98, 139, 160 y 193 días. A pesar de que se obtuvo efecto contraceptivo, la necesidad de aplicar varias dosis hace que sea poco práctico para su utilización en el manejo de poblaciones felinas. Además, se requieren más estudios para garantizar su eficacia y seguridad (Levy et al., 2004; Munson, 2006).
Vacunas anti-GnRH
La GnRH es un decapéptido que mantiene una estructura similar entre los mamíferos; esto hace que sea una adecuada opción para su uso en la inmunocontracepción. Debido a su escasa antigenicidad debe conjugarse con proteínas de alto peso molecular y adyuvantes que faciliten la respuesta inmunológica (Levy, 2011; Murdoch, 1994).
Robbins et al. (2004) observaron que en gatas prepúberes la aplicación de dos dosis de una vacuna anti-GnRH suprimía la actividad reproductiva durante, al menos, 20 meses. El único efecto colateral registrado fue que la totalidad de las gatas presentaron una reacción no dolorosa en el sitio de inoculación que se resolvió en 28 días.
Por otra parte, GonaCon™ es una vacuna que induce la producción de anticuerpos que inactivan la GnRH. Esta vacuna es utilizada como contraceptivo en especies salvajes mediante la aplicación de una dosis, siendo efectivas durante, al menos, un año (Benka & Levy, 2015).
En gatas en las que se aplicó una dosis de GonaCon™ se observó infertilidad en el 100% de los casos (n=15). El 93% de las mismas se mantuvo infértil durante un año, aunque la duración del efecto fue sumamente variable (entre 5 meses y más de 5 años) (Levy et al., 2011). Una nueva fórmula de GonaCon™ indujo la producción de anticuerpos dentro de los 30 días posteriores a su administración, observándose, como efecto colateral, la presencia de masas en el lugar de la aplicación dentro de los 18 días y hasta un año luego de la vacunación (Vansandt et al., 2017).
Por el contrario, Fischer et al. (2018) observaron que al aplicar GonaCon™ se obtuvo un efecto contraceptivo durante, al menos, un año solamente en el 30% (n=6/20) de las gatas. Como efectos colaterales pudieron advertir la formación de masas en el lugar de la aplicación; no obstante, estas no fueron dolorosas ni ocasionaron dificultad para deambular. Además, la administración de GonaCon™ junto con la vacuna antirrábica resulta efectiva y segura a corto plazo (Novak et al., 2021).
Recientemente se ha comunicado que la aplicación de dos dosis de la vacuna Improvac. (Zoetis), con un intervalo de 30 días, ha permitido suprimir el estro entre 45 y 75 días. Mediante un seguimiento ecográfico pudo evidenciarse una disminución gradual del diámetro uterino desde el día 0 al día 75. Asimismo, luego de la vacunación, las gatas presentaron una disminución transitoria del conteo de eritrocitos, de la concentración de hemoglobina y del hematocrito. Además, los sólidos totales incrementaron su concentración y los niveles superaron el intervalo de referencia para la especie (Carrasco Sangache et al., 2021; García Mitacek et al., 2021).
Si bien las vacunas anti-GnRH han mostrado no ser completamente efectivas en todos los casos, su prolongada efectividad y la posibilidad de requerir una o dos dosis las mantienen como una alternativa prometedora para su utilización. Es así que futuras investigaciones son necesarias para encontrar formulaciones que sean efectivas y seguras.
Conclusiones
Los progestágenos han sido ampliamente utilizados como contraceptivos debido a su eficacia. Sin embargo, los efectos adversos que producen han impulsado el desarrollo de nuevos métodos hormonales y no hormonales para el control de la reproducción. Si bien muchos de ellos son efectivos, el inicio y la duración de su efecto no siempre es predecible.
La melatonina produce contracepción durante corto tiempo, lo que hace que no sea de utilidad en poblaciones de gatos ferales. Por el contrario, los implantes con análogos de la GnRH producen mayor duración del efecto contraceptivo.
La inmunocontracepción es una alternativa prometedora, ya que ha mostrado un efecto contraceptivo prolongado. Asimismo, las vacunas pueden ser administradas rápidamente por personal entrenado sin requerir anestesia. Finalmente, debido a que son métodos no hormonales, constituyen una opción adecuada para evitar el uso de progestágenos que producen efectos adversos. Sin embargo, los estudios realizados han mostrado variabilidad individual, así como diferentes tiempos de acción anticonceptiva, por lo cual aún se requieren estudios para encontrar formulaciones de mayor eficacia, confirmar su seguridad a largo plazo y determinar la duración de su efecto.
Agradecimientos
Este trabajo fue financiado por la Universidad Estatal de Bolívar, Ecuador.
Conflicto de intereses
No existe conflicto de intereses, incluyendo entre estos últimos las relaciones financieras, personales o de otro tipo con otras personas u organizaciones que pudieran influir de manera inapropiada en el trabajo.
Bibliografía
Asa CS. 2018. Contraception in dogs and cats. Veterinary Clinics of North America: Small Animal Practice. 48(4):733-42. https://doi.org/10.1016/j.cvsm.2018.02.014
Baldwin CJ, Peter AT, Bosu WTK, Dubielzig RR. 1994. The contraceptive effects of levonorgestrel in the domestic cat. Laboratory Animal Science. 44(3):261-9.
Benka VAW, Levy JK. 2015. Vaccines for feline contraception: GonaCon GnRH-hemocyanin conjugate immunocontraceptive. Journal of Feline Medicine and Surgery. 17(9):758-65. https://doi.org/10.1177/1098612X15594989
Burke TJ. 1982. Pharmacologic control of estrus in the bitch and queen. Veterinary Clinics of North America: Small Animal Practice. 12(1):79-84. https://doi.org/10.1016/S0195-5616(82)50007-1
Burke TJ. 1976. Feline reproduction. Veterinary Clinics of North America. 6(3):317-31. https://doi.org/10.1016/S0091-0279(76)50051-7
Burke TJ, Reynolds HA, Sokolowski JH. 1977. A 280-day tolerance-efficacy study with mibolerone for suppression of estrus in the cat. American Journal of Veterinary Research. 38(4):469-77.
Carrasco Sangache WF, García Mitacek MC, Stornelli MC, Nuñez Favre R, Segura Ochoa JJ, Tebés M, Stornelli MA. 2021. Evaluación de parámetros hematológicos en gatas (Felis catus) tratadas con una vacuna anti-hormona liberadora de gonadotropina. Resultados preliminares. XXI Jornadas de Divulgación Técnico Científicas, Facultad de Ciencias Veterinarias, Universidad Nacional de Rosario. Santa Fe, Argentina.
Cecchetto M, Salata P, Baldan A, Milani C, Mollo A, Fontaine C, Sontas H, Gelli D, De Benedictis G, Stelletta C, Romagnoli S. 2017. Postponement of puberty in queens treated with deslorelin. Journal of Feline Medicine and Surgery. 19(12):1224-30. https://doi.org/10.1177/1098612X16688406
Colton MW. 1965. Progestational agents in pet practice, indications, agents and doses, precautions. Modern Veterinary Practice. 1965:53-6.
Conn PM, Crowley WF. 1991. Gonadotropin-releasing hormone and its analogues. New England Journal of Medicine. 324(2):93-103. https://doi.org/10.1056/NEJM199101103240205
Doherty TS, Dickman CR, Johnson CN, Legge SM, Ritchie EG, Woinarski JCZ. 2017. Impacts and management of feral cats Felis catus in Australia. Mammal Review. 47(2):83-97. https://doi.org/10.1111/mam.12080
Drost M, Thatcher WW. 1992. Application of gonadotrophin releasing hormone as therapeutic agent in animal reproduction. Animal Reproduction Science. 28(1-4):11-9. https://doi.org/10.1016/0378-4320(92)90086-S
Eade JA, Roberston ID, James CM. 2009. Contraceptive potential of porcine and feline zona pellucida A, B and C subunits in domestic cats. Reproduction. 137(6):913-22. https://doi.org/10.1530/REP-08-0471
Faya M, Carranza A, Priotto M, Graiff D, Zurbriggen G, Diaz JD, Gobello C. 2011. Long-term melatonin treatment prolongs interestrus, but does not delay puberty, in domestic cats. Theriogenology. 75(9):1750-4. https://doi.org/10.1016/j.theriogenology.2011.01.015
Findik M, Maral NE, Aslan S. 1999. The use of proligestone, megestrol acetate and GnRH on queens with the aim of hormonal contraception. Turkish Journal of Veterinary and Animal Sciences. 23(Suppl. 3):455-9.
Fischer A, Benka VA, Briggs JR, Driancourt M-A, Maki J, Mora DS, Morris KN, Myers KA, Rhodes L, Vansandt LM, Weedon GR, Wolf J, Levy JK. 2018. Effectiveness of GonaCon as an immunocontraceptive in colony-housed cats. Journal of Feline Medicine and Surgery. 20(8):786-92. https://doi.org/10.1177/1098612X18758549
Fontaine C. 2015. Long-term contraception in a small implant: A review of suprelorin (deslorelin) studies in cats. Journal of Feline Medicine and Surgery. 17(9):766-71. https://doi.org/10.1177/1098612X15594990
Furthner E, Roos J, Niewiadomska Z, Maenhoudt C, Fontbonne A. 2020. Contraceptive implants used by cat breeders in France: A study of 140 purebred cats. Journal of Feline Medicine and Surgery. 22(10):984-92. https://doi.org/10.1177/1098612X19901023
García Mitacek MC. Ciclo estral felino. En: Stornelli MA, De la Sota RL. 2016. Manual de Reproducción de Animales de Producción y Compañía. Edulp, La Plata, pp. 70-6.
García Mitacek MC, Carrasco Sangache WF, Stornelli MC, García MF, Coralli F, Praderio R, Stornelli MA. 2021. Evaluación de cambios ultrasonográficos uterinos en gatas tratadas con la vacuna Anti-GnRH Improvac. (Zoetis). Resultados preliminares. XXI Jornadas de Divulgación Técnico Científicas FCV UNR. Santa Fe, Argentina.
Gerber HA, Jöchle W, Sulman FG. 1973. Control of reproduction and of undesirable social and sexual behaviour in dogs and cats. Journal of Small Animal Practice. 14:151-8. https://doi.org/10.1111/j.1748-5827.1973.tb06910.x
Gimenez F, Stornelli MC, Tittarelli CM, Savignone CA, Dorna IV, de la Sota RL, Stornelli MA. 2009. Suppression of estrus in cats with melatonin implants. Theriogenology. 72(4):493-9. https://doi.org/10.1016/j.theriogenology.2009.04.004
Gobello C. 2012. Effects of GnRH antagonists vs agonists in domestic carnivores, a review. Reproduction in Domestic Animals. 47(Suppl. 6):373-6. https://doi.org/10.1111/rda.12025
Goericke-Pesch S. 2010. Reproduction control in cats: New developments in non-surgical methods. Journal of Feline Medicine and Surgery. 12(7):539-46. https://doi.org/10.1016/j.jfms.2010.05.005
Goericke-Pesch S, Georgiev P, Atanasov A, Albouy M, Navarro C, Wehrend A. 2013. Treatment of queens in estrus and after estrus with a GnRH-agonist implant containing 4.7 mg deslorelin; hormonal response, duration of efficacy, and reversibility. Theriogenology. 79(4):640-6. https://doi.org/10.1016/j.theriogenology.2012.11.018
Gorman SP, Levy JK, Hampton AL, Collante WR, Harris AL, Brown RG. 2002. Evaluation of a porcine zona pellucida vaccine for the immunocontraception of domestic kittens (Felis catus). Theriogenology. 58(1):135-49. https://doi.org/10.1016/S0093-691X(02)00904-4
Graham LH, Swanson WF, Wildt DE, Brown JL. 2004. Influence of oral melatonin on natural and gonadotropin-induced ovarian function in the domestic cat. Theriogenology. 61(6):1061-76. https://doi.org/10.1016/j.theriogenology.2003.05.004
Greenberg M, Lawler D, Zawistowski S, Jöchle W. 2013. Low-dose megestrol acetate revisited: A viable adjunct to surgical sterilization in free roaming cats? The Veterinary Journal. 196(3):304-8. https://doi.org/10.1016/j.tvjl.2013.01.038
Gulyuz F, Tasal I, Uslu BA. 2009. Effects of melatonin on the onset of ovarian activity in turkish van cats. Journal of Animal and Veterinary Advances. 8(10):2033-7.
Harris TW, Wolchuk N. 1963. The suppression of estrus in the dog and cat with long-term administration of synthetic progestational steroids. American Journal of Veterinary Research. 24:1003-6.
Herbst KL. 2003. Gonadotropin-releasing hormone antagonists. Current Opinion in Pharmacology. 3(6):660-6. https://doi.org/10.1016/j.coph.2003.06.009
Hernandez FJ, Fernandez BB, Chertack M, Gage PA. 1975. Feline mammary carcinoma and progestogens. Feline Practice. 5(5):45-8.
Ivanova M, Petrov M, Klissourska D, Mollova M. 1995. Contraceptive potential of porcine zona pellucida in cats. Theriogenology. 43(5):969-81. https://doi.org/10.1016/0093-691X(95)00046-B
Jackson EKM. 1984. Contraception in the dog and cat. British Veterinary Journal. 140(2):132-7. https://doi.org/10.1016/0007-1935(84)90073-3
Jöchle W, Jöchle M. 1975. Reproductive and behavioral control in the male and female cat with progestins: Long-term field observations in individual animals. Theriogenology. 3(5):179-85. https://doi.org/10.1016/0093-691X(75)90002-3
Keskin A, Yilmazbas G, Yilmaz R, Ozyigit MO, Gumen A. 2009. Pathological abnormalities after long-term administration of medroxyprogesterone acetate in a queen. Journal of Feline Medicine and Surgery. 11(6):518-21. https://doi.org/10.1016/j.jfms.2008.10.006
Kutzler M, Wood A. 2006. Non-surgical methods of contraception and sterilization. Theriogenology. 66(3):514-25. https://doi.org/10.1016/j.theriogenology.2006.04.014
Levy JK. 2011. Contraceptive vaccines for the humane control of community cat populations. American Journal of Reproductive Immunology. 66(1):63-70. doi.org/10.1111/j.1600-0897.2011.01005.x
Levy JK, Friary JA, Miller LA, Tucker SJ, Fagerstone KA. 2011. Long-term fertility control in female cats with GonaConTM, a GnRH immunocontraceptive. Theriogenology. 76(8):1517-25. https://doi.org/10.1016/j.theriogenology.2011.06.022
Levy JK, Mansour M, Crawford PC, Pohajdak B, Brown RG. 2005. Survey of zona pellucida antigens for immunocontraception of cats. Theriogenology. 63(5):1334-41. https://doi.org/10.1016/j.theriogenology.2004.07.015
Levy JK, Miller LA, Cynda Crawford P, Ritchey JW, Ross MK, Fagerstone KA. 2004. GnRH immunocontraception of male cats. Theriogenology. 62(6):1116-30. https://doi.org/10.1016/j.theriogenology.2003.12.025
Leyva H, Addiego L, Stabenfeldt G. 1984. The effect of different photoperiods on plasma concentrations of melatonin, prolactin, and cortisol in the domestic cat. Endocrinology. 115(5):1729-36. https://doi.org/10.1210/endo-115-5-1729
Leyva H, Madley T, Stabenfeldt GH. 1989. Effect of light manipulation on ovarian activity and melatonin and prolactin secretion in the domestic cat. Journal of Reproduction and Fertility. Supplement. 39:125-33.
Looper S, Anderson G, Sun Y, Shukla A, Lasley B. 2001. Efficacy of levonorgestrel when administered as an irradiated, slow-release injectable matrix for feline contraception. Zoo Biology. 20(5):407-21. https://doi.org/10.1002/zoo.1039
Loretti AP, da Silva Ilha MR, Ordás J, de las Mulas JM. 2005. Clinical, pathological and immunohistochemical study of feline mammary fibroepithelial hyperplasia following a single injection of depot medroxyprogesterone acetate. Journal of Feline Medicine and Surgery. 7(1):43-52. https://doi.org/10.1016/j.jfms.2004.05.002
Mehl NS, Srisuwatanasagul S, Swangchan-Uthai T, Sirivaidyapong S, Khalid M. 2017. GnRH-agonist implants suppress reproductive function and affects ovarian LHR and FSHR expression in prepubertal female cats. Theriogenology. 87:250-8. https://doi.org/10.1016/j.theriogenology.2016.09.003
Munson L. 2006. Contraception in felids. Theriogenology. 66(1):126-34. https://doi.org/10.1016/j.theriogenology.2006.03.016
Munson L, Bauman JE, Asa CS, Jöchle W, Trigg TE. 2001. Efficacy of the GnRH analogue deslorelin for suppression of oestrous cycles in cats. Journal of Reproduction and Fertility. Supplement. 57:269-73.
Munson L, Harrenstien LA, Acton AE, Graham PA, Chassy LM, Kirkpatrick JF. 2005. Immunologic responses and adverse reactions to Freund’s-adjuvanted porcine zona pellucida immunocontraceptives in domestic cats. Vaccine. 23(48-49):5646-54. https://doi.org/10.1016/j.vaccine.2005.05.044
Murakoshi M, Tagawa M, Ikeda R, Hoshino T, Suzuki M, Nakayama T. 1996. The effect of subcutaneous implantation of chlormadinone acetate for preventing estrus in queens. Journal of Toxicologic Pathology. 9(2):185-90. https://doi.org/10.1293/tox.9.185
Murdoch WJ. 1994. Immunoregulation of mammalian fertility. Life Sciences. 55(24):1871-86. https://doi.org/10.1016/0024-3205(94)00519-2
Murray JK, Mosteller JR, Loberg JM, Andersson M, Benka VAW. 2015. Methods of fertility control in cats: Owner, breeder and veterinarian behavior and attitudes. Journal of Feline Medicine and Surgery. 17(9):790-9. https://doi.org/10.1177/1098612X15594994
Naz RK. 2011. Contraceptive vaccines: Success, status, and future perspective. American Journal of Reproductive Immunology. 66(1):2-4. https://doi.org/10.1111/j.1600-0897.2011.00999.x
Novak S, Yakobson B, Sorek S, Morgan L, Tal S, Nivy R, King R, Jaebker L, Eckery DC, Raz T. 2021. Short term safety, immunogenicity, and reproductive effects of combined vaccination with anti-GnRH (Gonacon) and rabies vaccines in female feral cats. Frontiers in Veterinary Science. 8:650291. https://doi.org/10.3389/fvets.2021.650291
Ochota M, Nowak M, Dzieciol M, Nizanski W. 2014. Mammary adenocarcinoma after ten-year medroxyprogesterone acetate supplementation in an ovariectomized cat. Pakistan Veterinary Journal. 34(3):406-9.
Padula AM. 2005. GnRH analogues--agonists and antagonists. Animal Reproduction Science. 88(1-2):115-26. https://doi.org/10.1016/j.anireprosci.2005.05.005
Pandi-Perumal SR, Srinivasan V, Maestroni GJM, Cardinali DP, Poeggeler B, Hardeland R. 2006. Melatonin: Nature’s most versatile biological signal? The FEBS Journal. 273(13):2813-38. https://doi.org/10.1111/j.1742-4658.2006.05322.x
Pelican KM, Brown JL, Wildt DE, Ottinger MA, Howard JG. 2005. Short term suppression of follicular recruitment and spontaneous ovulation in the cat using levonorgestrel versus a GnRH antagonist. General and Comparative Endocrinology. 144(2):110-21. https://doi.org/10.1016/j.ygcen.2005.04.014
Pelican KM, Wildt DE, Ottinger MA, Howard J. 2008. Priming with progestin, but not GnRH antagonist, induces a consistent endocrine response to exogenous gonadotropins in induced and spontaneously ovulating cats. Domestic Animal Endocrinology. 34(2):160-75. https://doi.org/10.1016/j.domaniend.2007.01.002
Purswell BJ, Kolster KA. 2006. Immunocontraception in companion animals. Theriogenology. 66(3):510-3. https://doi.org/10.1016/j.theriogenology.2006.04.018
Robbins SC, Jelinski MD, Stotish RL. 2004. Assessment of the immunological and biological efficacy of two different doses of a recombinant GnRH vaccine in domestic male and female cats (Felis catus). Journal of Reproductive Immunology. 64(1-2):107-19. https://doi.org/10.1016/j.jri.2004.08.004
Risso A, Valiente C, Corrada Y, García Romero G, Blanco PG, de la Sota PE, Diaz JD, Gobello C. 2010. The GnRH antagonist acyline prevented ovulation, but did not affect ovarian follicular development or gestational corpora lutea in the domestic cat. Theriogenology. 73(7):984-7. https://doi.org/10.1016/j.theriogenology.2010.01.010
Romagnoli S. 2015. Progestins to control feline reproduction: Historical abuse of high doses and potentially safe use of low doses. Journal of Feline Medicine and Surgery. 17(9):743-52. https://doi.org/10.1177/1098612X15594987
Romagnoli S, Sontas H. Prevention of breeding in the female. En: England G, von Heimendahl A. 2010. BSAVA Manual of Canine and Feline Reproduction and Neonatology. British Small Animal Veterinary Association, Gloucester, pp. 23-33.
Root Kustritz MV. 2018. Population control in small animals. Veterinary Clinics of North America: Small Animal Practice. 48(4):721-32. https://doi.org/10.1016/j.cvsm.2018.02.013
Rubion S, Driancourt M. 2009. Controlled delivery of a GnRH agonist by a silastic implant (Gonazon) results in long-term contraception in queens. Reproduction in Domestic Animals. 44(2):79-82. https://doi.org/10.1111/j.1439-0531.2009.01415.x
Sarchahi AA, Emadi M, Azarpeykan S. 2008. Effects of three steroidal compounds on oestrus suppression in queens. Iranian Journal of Veterinary Research. 9(2):144-9.
Sawada T, Tamada H, Inaba T, Mori J. 1992. Prevention of estrus in the queen with chlormadinone acetate administered orally. Journal of Veterinary Medical Science. 54(5):1061-2. https://doi.org/10.1292/jvms.54.1061
Saxena BB, Clavio A, Singh M, Rathnam P, Bukharovich EY, Reimers TJ, Saxena A, Perkins S. 2003. Effect of immunization with bovine luteinizing hormone receptor on ovarian function in cats. American Journal of Veterinary Research. 64(3):292-8. https://doi.org/10.2460/ajvr.2003.64.292
Sparkes AH, Bessant C, Cope K, Ellis SLH, Finka L, Halls V, Hiestand K, Horsford K, Laurence C, MacFarlaine I, Neville PF, Stavisky J, Yeates J. 2013. ISFM guidelines on population management and welfare of unowned domestic cats (Feliscatus). Journal of Feline Medicine and Surgery. 15(9):811-7. https://doi.org/10.1177/1098612X13500431
Stewart RA, Pelican KM, Brown JL, Wildt DE, Ottinger MA, Howard JG. 2010. Oral progestin induces rapid, reversible suppression of ovarian activity in the cat. General and Comparative Endocrinology. 166(2):409-16. https://doi.org/10.1016/j.ygcen.2009.12.016
Tamada H, Kawate N, Inaba T, Sawada T. 2003. Long-term prevention of estrus in the bitch and queen using chlormadinone acetate. Canadian Veterinary Journal. 44(5):416-7.
Toydemir TSF, Kılıçarslan MR, Olgaç V. 2012. Effects of the GnRH analogue deslorelin implants on reproduction in female domestic cats. Theriogenology. 77(3):662-74. https://doi.org/10.1016/j.theriogenology.2011.07.046
Vansandt L, Kutzler M, Fischer A, Morris K, Swanson W. 2017. Safety and effectiveness of a single and repeat intramuscular injection of a GnRH vaccine (GonaConTM) in adult female domestic cats. Reproduction in Domestic Animals. 52(2):348-53. https://doi.org/10.1111/rda.12853
Veitch CR. 2001. The eradication of feral cats (Felis catus) from little barrier island, New Zealand. New Zealand Journal of Zoology. 28(1):1-12. https://doi.org/10.1080/03014223.2001.9518252
Vitásek R, Dendisová H. 2006. Treatment of feline mammary fibroepithelial hyperplasia following a single injection of proligestone. Acta Veterinaria Brno. 75(2):295-7. https://doi.org/10.2754/avb200675020295
Welsh P. 2018. Cat neutering: The earlier the better to tackle overpopulation. Veterinary Record. 182(10):289-90. https://doi.org/10.1136/vr.k1028

