Trabajos de Investigación
Detección de anticuerpos contra Brucella abortus en perros en contacto con zona rural. Aspectos zoonóticos de la infección
Detection of antibodies against Brucella abortus in dogs in contact with rural areas. Zoonotic aspects of the infection
ANALECTA VETERINARIA
Universidad Nacional de La Plata, Argentina
ISSN: 1514-2590
Periodicidad: Semestral
vol. 39, núm. 2, 2019
Recepción: 12 Abril 2019
Revisado: 13 Mayo 2019
Aprobación: 26 Junio 2019

Resumen: La brucelosis es una enfermedad infectocontagiosa zoonótica de curso crónico y de distribución mundial. En los perros suele ser causada por B. canis; sin embargo, la B. abortus, asociada con el bovino infectado ha sido descripta en perros, tanto en la forma experimental como en condiciones de campo. La transmisión de perros a humanos también es posible. En esta comunicación se describe, por primera vez, en Argentina, la detección de anticuerpos contra B. abortus en una población de perros en contacto con zonas rurales. Se analizaron 67 muestras de sueros de perros, de los cuales 26,8 % fueron positivos para B. abortus mediante la técnica de aglutinación con antígeno tamponado, 7,5 % se confirmaron como positivos mediante las pruebas de aglutinación lenta en tubos y 4,5 % resultaron positivos mediante la prueba de fluorescencia polarizada. Los perros reaccionantes a B. abortus tuvieron contacto con ganado bovino seropositivo a brucelosis o eran perros de zona urbana que convivían con perros que habían concurrido a la zona rural. La eliminación de bovinos seropositivos no necesariamente puede erradicar la brucelosis. Se necesitarían más acciones de manejo para lograrlo, como evitar el contacto directo con perros e impedir la transmisión entre especies.
Palabras clave: Brucella abortus, perros, zoonosis, Argentina.
Abstract: Brucellosis is a zoonoticcontagious disease, usually of chronic evolution and worldwide distribution. Dog’s infection is typically caused for B. canis; however, B. abortus, associated with infected cattle has been described in dogs, both experimentally and in field conditions. The transmission of dogs to humans is also possible. This communication describes, for the first time in Argentina, the detection of antibodies against B. abortus in a population of dogs in contact with rural areas. Sixtyseven samples of dog sera were analyzed, of which 26.8 % were positive for B. abortus by means of the agglutination technique with buffered antigen, 7.5 % were confirmed as positive by tests of slow agglutination in tubes and 4, 5 % were positive by polarized fluorescence test. Dogs reacting to B. abortus had contact with seropositive cattle with brucellosis or were urban dogs that lived with dogs that had attended the rural area. Elimination of infected cattle may not necessarily eradicate brucellosis; management actions such as avoiding the contact of dogs from infected cows should prevent its transmission.
Keywords: Brucella abortus, dogs, zoonoses, Argentina.
Introducción
La brucelosis es una enfermedad infectocontagiosa de curso crónico y de distribución mundial, que afecta tanto al hombre como a los animales domésticos, la fauna silvestre y los mamíferos marinos. Las bacterias del género Brucella incluyen 11 especies reconocidas (Whatmore, 2009; Whatmore et al., 2014). Las cepas lisas son:
B. melitensis, B. abortus, B. suis, B. neotomae, B. ceti, B. pinnipedialis, B. microti, B. inopinata y B. papionis y las cepas rugosas son: B. ovis y B. canis(Nicola & Elena, 2009). Las cepas de campo de B. canis son siempre rugosas y tienen crecimiento de tipo mucoide (M+) después de varios días de incubación, especialmente en medios con pH 7,2. Si la bacteria desarrolla en medios con pH menor a 6,5 se obtienen variantes M. Las variantes M tienen una virulencia reducida, los animales se mantienen asintomáticos y la respuesta inmune evaluada mediante pruebas serodiagnósticas es más débil, especialmente si se utiliza B. ovis como antígeno (Carmichael et al., 1984a; 1984b).
Esta enfermedad es particularmente contagiosa y es posible la transmisión cruzada de especies de Brucella spp. (Olsen & Palmer, 2014). Todos los biovares de B. abortus y B. melitensis y los biovares 1, 3 y 4 de B. suis son patógenos para el ser humano (Godfroid et al., 2002; Maudlin et al., 2009). Por lo tanto, es considerada zoonosis, con carácter ocupacional, manifestándose en el hombre con fiebre, mialgias, cefalea, dermatitis, linfadenopatías y, ocasionalmente, poliartritis (Acha & Szyfres, 2001). Sin embargo, aunque es zoonótica, B. canis es menos reconocida como tal (Krueger et al., 2014).
La brucelosis en perros fue reportada en todo el mundo, siendo endémica en América, Asia y África, donde los estudios serológicos en numerosos países establecieron una gama de seropositividad del 1 al 28 % (McDermott et al., 2013). En perros, la enfermedad tiene como principal agente etiológico a B. canis(Carmichael & Greene, 1998), pero hay informes de contagio por B. abortus, B. suis y B. melitensis(Barr et al., 1986; Bicknell et al., 1976; Prior, 1976; Miranda et al., 2005; Sandoval et al., 1976).
La infección natural de perros por B. abortus es de ocurrencia esporádica y resulta del contacto estrecho del animal, generalmente de zona rural, con bovinos infectados. Esto ocurre habitualmente por ingestión de tejido animal, restos placentarios o fetos abortados contaminados con la bacteria (Azevedo et al., 2003; Carmichael & Greene, 1998; Miranda et al., 2005). Los caninos parecen ser más resistentes a Brucella spp. lisas, siendo raras las manifestaciones clínicas derivadas de la enfermedad, aunque, en asociación con bacteriemia transitoria, algunos animales pueden presentar linfadenopatías y otras manifestaciones de la infección (Azevedo et al., 2003). Luego del contacto con la Brucella, los anticuerpos se hacen detectables a partir de las dos semanas posinfección (Johnson et al., 1983). En forma similar a todas las afecciones por Brucella spp., en la primera fase de la respuesta humoral predomina la IgM, la que va siendo paulatinamente superada por la IgG; esta predomina en la respuesta crónica (Carmichael et al., 1984a, 1984b).
La identificación de los perros enfermos es de suma importancia porque constituyen fuentes de contaminación, ya que pueden eliminar el agente infeccioso por orina, semen, secreciones vaginales, fetos abortados o heces (Baek et al., 2003; Forbes, 1990). La presencia y persistencia de B. abortus en descargas vaginales de perras por un lapso superior a los 42 días después del parto o aborto fue descrita por Baek et al. (2003). Esta descarga, junto con restos de abortos de las perras enfermas, es el material de mayor riesgo en la transmisión del agente a los propios perros y animales de producción (Forbes, 1990).
El diagnóstico de laboratorio para B. canis rutinariamente incluye la prueba de aglutinación rápida en portaobjetos (RSAT) y la inmunodifusión en gel de agar (AGID) (Robles, 1998). Estas dos pruebas presentan disminución de la especificidad dado que los antígenos de superficie de Brucellas rugosas reaccionan en forma cruzada con los anticuerpos producidos por otras especies de bacterias no patógenas (Shin & Carmichael, 1999). Debido a esto, se han mejorado las técnicas diagnósticas, implementándose una RSAT que utiliza un antígeno M, una AGID que utiliza antígenos proteínicos citoplasmáticos y pruebas de ELISA e inmunofluorescencia. El uso de un antígeno proveniente de una variante M de B. canis, en reemplazo del antígeno de B. ovis, reduce la tasa de falsos positivos. Para el diagnóstico de B. abortus, el Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA) establece, como oficiales, las siguientes técnicas: aglutinación con antígeno tamponado (BPA), seroaglutinación lenta en tubo (SAT) o prueba de Wright, de 2mercaptoetanol (2Me), fluorescencia polarizada (FPA), fijación de complemento (FC), ELISAI (indirecto) y ELISAC (competición) (Nielsen, 2002).
Si bien existe una comunicación que informa sobre la presencia de anticuerpos contra B. abortus en perros del conurbano sur bonaerense (Eiras et al., 2014), hasta la fecha no se conocen datos epidemiológicos sobre la infección humana por B. abortus a través de los mismos. El objetivo de este trabajo fue detectar, en sueros de perros del sudoeste de la Provincia de Buenos Aires, Argentina, la presencia de anticuerpos contra B. abortus, haciendo hincapié en el posible impacto zoonótico de esta enfermedad.
Materiales y métodos
Se realizó un estudio descriptivo y observacional, empleando 67 muestras de sangre de caninos, con propietario, recolectados por el Laboratorio Coronel Suárez, de Coronel Suárez, en el sudoeste de la Provincia de Buenos Aires, durante los años 2017 y 2018. Los propietarios dieron su consentimiento para la toma de la muestra. La muestra estaba compuesta por 35 animales que habitaban en zona rural, 29 animales que habitaban en zona urbana, pero que concurrían asiduamente al campo transportados por sus dueños, y 3 animales que habitaban en zona urbana y convivían con perros que concurrían al campo.
Se obtuvieron entre 3 y 5 ml de sangre de la vena yugular externa o cefálica antebraquial, se separó el suero y se conservó congelado a 20 °C hasta el momento de su procesamiento. La información de cada animal (sexo, edad y hábitos de vida) se registró en una planilla Excel® confeccionada para tal fin.
Para detectar anticuerpos anti B. canis se efectuó la prueba rápida, cualitativa de RSAT, de acuerdo con las recomendaciones de Carmichael & Joubert (1987), incluyendo en cada portaobjetos un suero control positivo. El antígeno fue producido por el SENASA utilizando la cepa B. canis M, coloreado con Rosa de Bengala y sin 2Me. La técnica se realizó utilizando 10 µl de suero y 10 µl de antígeno. La lectura se realizó a los 2 minutos, considerándose positiva cuando hubo presencia de grumos y negativa cuando la mezcla manifestó turbidez homogénea sin grumos.
Para detectar anticuerpos anti B. abortus se realizó, en primer término, la prueba de BPA (aglutinación rápida), de acuerdo con los procedimientos estandarizados (Alton et al., 1988) y con antígeno producido por SENASA, ya que es la prueba tamiz oficialmente aceptada en la Argentina para el diagnóstico de brucelosis bovina. Se utilizaron 80 µl de suero y 30 µl de antígeno y la lectura se realizó a los 8 minutos. En caso de resultados negativos (turbidez homogénea) no se realizó ninguna otra prueba y en caso de resultados positivos (aparición de grumos) se realizaron las pruebas confirmatorias de SAT, 2Me y FPA, de acuerdo a las indicaciones del Manual de diagnóstico serológico de la brucelosis bovina del SENASA del año 2009 (Nicola & Elena, 2009).
Las pruebas de SAT y 2Me son cuantitativas de aglutinación lenta en tubo. Para la prueba de SAT, con la que se determinó IgG e IgM, se utilizaron 4 diluciones de suero en solución salina fenolada (1/25, 1/50, 1/100 y 1/200). Para la prueba de 2Me, se realizaron las mismas diluciones en solución salina con 2Me y solo se determinó IgG, ya que el compuesto con radical tiol produce alteraciones en los enlaces disulfuros y genera un impedimento estérico sobre las IgM, quedando monómeros que no tienen capacidad de aglutinar. La lectura de la reacción para ambas técnicas se realizó a las 4048 horas y el grado de aglutinación fue definido como: a) completo: unión antígeno/anticuerpo (mezcla) con líquido límpido y sin ruptura de grumos ante la agitación suave; b) incompleto: mezcla parcialmente turbia en la que la leve agitación no produjo ruptura de los grumos; c) negativo: mezcla turbia en la que ante la agitación no se observaron grumos.
Para la prueba de FPA, se utilizó un antígeno que consiste en un pequeño fragmento de peso molecular promedio de 22 kD, de Opolisacárido del lipopolisacárido de B. abortus 11193, conjugado con isotiocianato de fluoresceína. El mismo se incubó con una dilución 1/100 de suero (10 µl de suero en 990 µl de solución tamponada de fosfatos). A los dos minutos se realizó la lectura de los resultados en un analizador fluorescente (Sentry 100, Diachemix DLL, EE. UU.) y se expresaron en unidades de milipolarización (mP), siendo negativos los valores ≤ 94 mP, sospechosos aquellos entre 94105 mP y positivos los ≥105 mP.
Resultados
La población analizada consistió en 67 perros (31 hembras y 36 machos) con un promedio de edad de 4,5 años (rango 1 a 10) en las hembras y de 4,6 años (rango 1 a 11) en los machos.
En referencia a la prueba tamiz de BPA, 18 de los 67 sueros (26,8 %) fueron positivos y la reactividad fue de 36 % (13/36) entre los machos y de 16 % (5/31) entre las hembras. Utilizando los criterios de interpretación de resultados para bovinos no vacunados, los resultados obtenidos a partir de los animales positivos a la prueba tamiz y analizados por las pruebas confirmatorias se muestran en la Tabla 1.
Solo 2 de los animales resultaron positivos a la prueba de RSAT para B. canis y uno de ellos resultó también positivo a la prueba de BPA (Tabla 1).
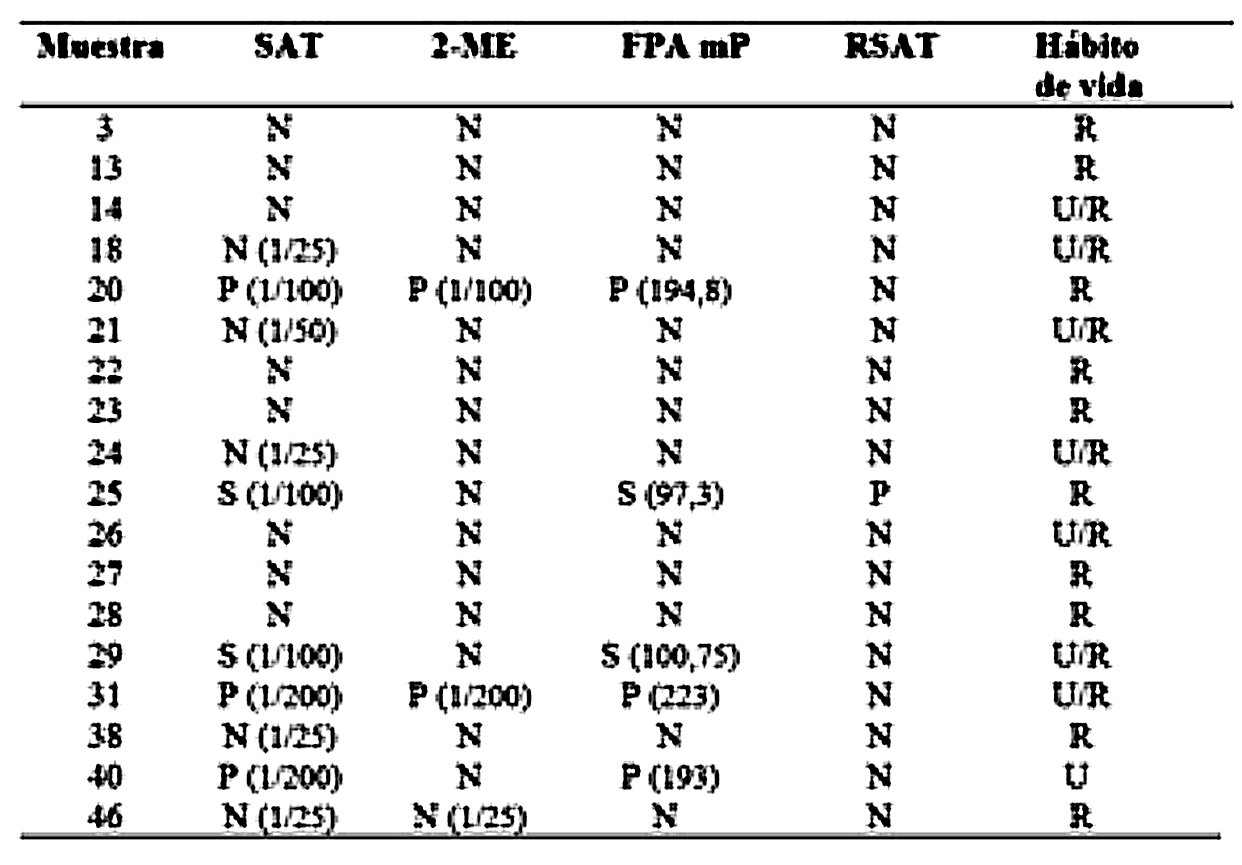
Resultados obtenidos mediante pruebas diagnósticas de brucelosis, aplicadas a los sueros detectados positivos, utilizando la prueba de antígeno tamponado en placa (BPA). Se detallan los valores hallados mediante las técnicas confirmatorias.
P= positivo; N=negativo; S=sospechoso; U=urbano; U/ R=urbano y rural; R=rural.Discusión y conclusiones
Las cepas de Brucella lisas (B. abortus, B. suis o B. melitensis) expresan la cadena lateral O inmunodominante en el lipopolisacárido de su superficie. Esto hace que esta cadena lateral forme la base antigénica de las pruebas de diagnóstico BPA, SAT y 2ME, pudiendo, de esta manera, detectarse especies lisas. Las pruebas para especies de Brucella rugosas, como B. canis, difieren de las pruebas para Brucella lisas, ya que B. canis no contiene la cadena lateral O en su superficie y la prueba RSAT es la que se emplea para su análisis serológico. Por lo tanto, no es posible que los perros infectados por B. canis resulten positivos para la prueba de B. abortus y viceversa (MateudeAntonio et al., 1994).
Para realizar estudios en caninos, no se ha diseñado ni estandarizado, hasta el momento, ningún ensayo que permita el diagnóstico indirecto de la infección con especies de Brucella lisas. Los métodos serológicos empleados para la detección de la enfermedad son los mismos que se aplican en los bovinos, no existiendo criterios uniformes para su utilización en perros (McGiven et al.; 2003; Nicola & Elena, 2009; Nielsen et al., 2005; Vargas, 2002). Las pruebas serológicas oficiales en nuestro país para la especie bovina han sido establecidas por el SENASA en la Resolución 438/2006 (Nicola & Elena, 2009). La prueba de FPA es una prueba de referencia internacional y es utilizada en caso de ser necesario corroborar un resultado (Araoz et al., 2014). No existen antecedentes sobre el uso de FPA en perros. Los datos de este trabajo, podrían constituir, en un futuro, una herramienta útil de diagnóstico, si se establece el punto de corte y la concordancia con las pruebas clásicas de SAT y 2Me en la especie canina.
En este estudio se halló que del 26,8% de las muestras positivas a la prueba tamiz de BPA, solo el 7,5% fue confirmado mediante SAT y 2Me (con resultados mayores o iguales a 1/100) y reconfirmado mediante la prueba de FPA. La presencia de falsos positivos a la prueba de BPA puede deberse a reacciones cruzadas con otras bacterias gram negativas que comparten un lipopolisacárido superficial similar al que presenta Brucella(Gall et al., 2006; Godfroid et al., 2002). Estas interacciones han sido estudiadas minuciosamente en los bovinos (MainarJaime et al., 2005), por lo que es factible que en los caninos también sean causa importante de interferencia en el diagnóstico de brucelosis.
El análisis de la información obtenida de cada animal mostró que los perros de zona rural seropositivos a B. abortus vivían próximos al ganado vacuno diagnosticado positivo de acuerdo a los procedimientos establecidos en la Resolución 438/2006 de SENASA, y podían tener acceso a fetos abortados y placentas de vacas infectadas. En el caso de los perros de zona urbana, estos convivían con perros que concurrían asiduamente al campo. Las descargas vaginales del ganado positivo a B. abortus persisten por más de 40 días después del aborto o parto y se convierten en una fuente de infección para perros (Moreno, 2014). La dosis infecciosa para perros es de aproximadamente 106 a 1010 organismos/g (Pidgeon, 1987). La seroconversión en perros infectados por B. abortus puede ocurrir entre 5 y 20 días después de la infección y ha sido reportada la diseminación de Brucella spp. en el medio ambiente a través de la orina o heces (Pidgeon, 1987). Esta vía podría explicar la infección de los perros de zona urbana que no han concurrido al campo y que podrían haberse infectado al ingerir o tomar contacto con fómites o materiales biológicos, tales como heces u orina contaminadas con Brucella spp. de los perros de zona urbana y que concurrieron al campo.
Según la legislación vigente en Argentina, el ganado seropositivo a brucelosis debe eliminarse bajo un programa de vigilancia para evitar la propagación de la enfermedad. Hasta el momento, no hay evidencias que reporten que los perros desempeñen un papel epidemiológico activo en la transmisión de B. abortus a humanos o al ganado. Si bien la brucelosis en caninos no es parte del programa de vigilancia, los perros podrían desempeñar el papel de hospedadores reservorios para B. abortus. Esta fuente de transmisión no debe ser subestimada, ya que la transmisión cruzada de especies de Brucella spp. es posible (Olsen & Palmer, 2014). Existen reportes de la transmisión esporádica de B. canis de los perros domésticos al ser humano (Hensel et al., 2018). Además, otro informe describe la detección de B. suis en perros, advirtiendo sobre la posible transmisión al humano (Ramamoorthy et al., 2011).
Debido a que B. abortus es más patógena para los seres humanos que B. canis, las personas con sospecha de brucelosis y en contacto con perros de zona rural o perros de zona urbana pero que concurren al campo, deberían someterse a análisis para descartar o confirmar la presencia de anticuerpos antiBrucella. Pese a que el riesgo de transmisión parece ser leve, los perros infectados por B. abortus tienen el potencial de infectar el ganado vacuno y podrían ser una amenaza en la cadena de transmisión de esta enfermedad, lo cual podría tener consecuencias económicas desfavorables. La eliminación del ganado reactor no necesariamente puede erradicar la enfermedad, pero la eliminación de los perros que se hallan en contacto con rodeos infectados, podría ayudar al control de la misma. Durante los programas de erradicación, las pruebas serológicas de perros para B. abortus pueden ser un indicador valioso (centinela) de la presencia de brucelosis en el ganado bovino (Moreno, 2014).
La ingestión de productos lácteos contaminados es el mayor riesgo de infección por Brucella en áreas endémicas (Kose et al., 2014). Sin embargo, no se debe subestimar la transmisión potencial de B. abortus a humanos por perros que se han infectado por haber estado en contacto directo o indirecto con vacas infectadas.
Se estima que más del 60 % de los patógenos humanos están relacionados con animales, y la incidencia de una enfermedad se ve afectada por factores ambientales, por lo que diferentes enfoques son válidos para reducir la incidencia de enfermedades zoonóticas (Cutler et al., 2010). Uno de estos enfoques podría ser el concepto de “una salud”, aunque nunca antes se ha aplicado a la transmisión zoonótica de B. abortus a través de caninos (Day, 2011). Existe la necesidad de crear un marco conceptual para las enfermedades zoonóticas en caninos, aunque el concepto de “una salud” se ha discutido para las enfermedades emergentes con potencial pandémico (Godfroid et al., 2013; Uçan & Aras, 2015). En otras palabras, el potencial zoonótico de las infecciones de los perros, con la excepción de la rabia, ha sido ignorado en gran medida en todo el mundo. Por lo tanto, zoonosis como brucelosis (incluyendo el tipo canino), la equinococosis, la rabia y algunas otras, continúan afectando significativamente la salud humana (Moreno, 2014). Las principales razones para ello son el contacto cercano con los animales al compartir el mismo entorno y las deficiencias en los recursos financieros para controlarlos principalmente en países en vías de desarrollo.
Agradecimientos
Este trabajo fue financiado por el Laboratorio de Inmunología Veterinaria de la Facultad de Ciencias Veterinarias, UNLP, y es parte del Trabajo Final Integrador de la Carrera de Especialización en Diagnóstico Veterinario de Laboratorio del Med. Vet. Lautaro Pérez Meyer.
Conflicto de intereses
No existe conflicto de intereses que declarar.
Referencias
Acha PN, Szyfres B. 2001. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. Brucellosis. 3° Ed. Washington: OPS/OMS, pp. 2856 (Publicación Científica y Técnica, 580).
Alton GG, Jones LM, Angus RD, Verger JM. 1988. Techniques for the brucellosis Laboratory. Institute National de la Recherche Agronomique (INRA). Paris, p. 190.
Araoz L, Cruz ML, González del Pino F, Jorrat JJ, de la Vega AC. 2014. Estudio comparativo de distintas técnicas serológicas para el diagnóstico de brucelosis equina. Revista Agronómica del Noroeste Argentino. 34(2):1779.
Azevedo SS, Batista CSA, Alves CJ, Clementino LJ. 2003. Ocorrência de anticorpos contra Brucella abortus em cães errantes da cidade de Patos, Estado da Paraíba, Brasil. Arquivos do Instituto Biológico, São Paulo. 70(4):499-500.
Baek BK, Lim CW, Rahman MS, Kim CH, Oluoch A, Kakoma I. 2003. Brucella abortus infection in indigenous Korean dogs. Canadian Journal of Veterinary Research. 67(4):3124.
Barr SC, Eilts BE, Roy AF, Miller R. 1986. Brucella suis biotype 1 infection in a dog. Journal of the American Veterinary Medical Association. 189(1): 6867.
Bicknell SR, Bell RA, Richards PA. 1976. Brucella abortus in the bitch. Veterinary Record. 99(5):856. doi: 10.1136/vr.99.5.85
Carmichael LE, Zoha SJ, FloresCastro R. 1984a. Biological properties and dog response to a variant (M) strain of Brucella canis. Developments in Biological Standarization. 56:649-56.
Carmichael LE, Zoha SJ, FloresCastro R. 1984b. Problems in the serodiagnosis of canine brucellosis: dog responses to cell wall and internal antigens of Brucella canis. Developments in Biological Standarization. 56:37183.
Carmichael LE, Joubert JC. 1987. A rapid slide agglutination test for the serodiagnosis of Brucella canis infection that employs a variant (M) organism as antigen. Cornell Veterinarian. 77(1):3-12.
Carmichael LE, Greene CE. 1998. Canine Brucellosis. En: Greene, C.E. (Ed). Infectious diseases of the dog and cat. 2° Ed. Philadelphia,W.B. Saunders, pp. 24857.
Cutler SJ, Fooks AR, van der Poel WHM. 2010. Public health threat of new, reemerging, and neglected zoonoses in the industrialized world. Emerging Infectious Diseases. 16(1):17. doi: 10.3201/eid1601.081467
Day M. 2011. One health: the importance of companion animal vectorborne diseases. Parasites & Vector. 4:49-55. doi: 10.1186/17563305449
Eiras DF, Scodellaro C, Vezzani D, López G, Boero C, Sánchez R. 2014. Diagnóstico serológico de brucelosis en perros del conurbano sur bonaerense. Revista Argentina de Zoonosis y Enfermedades Infecciosas Emergentes 9(2):267.
Forbes LB. 1990. Brucella abortus infection in 14 farm dogs. Journal of the American Veterinary Medical Association. 196(6):9116.
Gall D, Nielsen K, Bermúdez RM, Muñóz Del Real MC, Halbert G, Groulx R, Moreno F, Chow EY, Checkley SL. 2006. Development of an indirect enzymelinked immunosorbent assay for detecting equine serum antibodies to the lipopolysaccharide of Salmonella abortus equi. Research in Veterinary Sciences. 81(2):2157. doi: 10.1016/j.rvsc.2005.11.004
Godfroid J, Saegerman C, Wellemans V. 2002. How to substantiate eradication of bovine brucellosis when aspecific serological reactions occur in the course of brucellosis testing. Veterinary Microbiology. 90(14):46177. doi: 10.1016/S03781135(02)002304
Godfroid J, Al Dahouk S, Pappas G, Roth F, Matope G, Muma J, Marcotty T, Pfeiffer D, Skjerve E. 2013. A “One Health” surveillance and control of brucellosis in developing countries: moving away from improvisation. Comparative Immunology, Microbiology and Infectious Diseases. 36(3): 2418. doi: 10.1016/j.cimid.2012.09.001
Hensel ME, Negron M, ArenasGamboa, AM. 2018. Brucellosis in dogs and public health risk. Emerging Infectious Diseases. 24(8):14016.
Johnson CA, Bull RW, Schirmer RG. 1983. Peripheral lymphocyte function in dogs with Brucella canis infection. Veterinary Immunology and Immunopathology. 4(4):42531.
Kose S, Serin Senger S, Akkoclu G, Kuzucu L, Ulu Y, Ersan G, Ouz F. 2014. Clinical manifestations, complications, and treatment of brucellosis: evaluation of 72 cases. Turkish Journal of Medical Sciences. 44(2):220-3. doi: 10.3906/sag111234
Krueger WS, Lucero NE, Brower A, Heil GL, Gray GC. 2014. Evidence for unapparent Brucella canis infections among adults with occupational exposure to dogs. Zoonoses Public Health 61(7): 509-18. doi: 10.1111/zph.12102
MainarJaime RC, Muñóz PM, de Miguel MJ, Grilló MJ, Marín CM, Moriyón I, Blasco JM. 2005. Specificity dependence between serological tests for diagnosing bovine brucellosis in Brucellafree farms showing false positive serological reactions due to Yersinia enterocolítica O:9. The Canadian Veterinary Journal. 46(10):9136.
MateudeAntonio EM, Martin M, Casal J. 1994. Comparison of serologic tests used in canine brucellosis diagnosis. Journal of Veterinary Diagnostic Investigation. 6(2):2579. doi: 10.1177/104063879400600220
Maudlin I, Eisler MC, Welburn SC. 2009. Neglected and endemic zoonoses. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 364(1530):277787. doi: 10.1098/rstb.2009.0067
McDermott J, Grace D, Zinsstag J. 2013. Economics of brucellosis impact and control in lowincome countries. Revue Scientifique et Technique. 32(1):24961.
McGiven JA, Tucker JD, Perrett LL, Stack JA, Brew SD, MacMillan AP. 2003. Validation of FPA and cELISA for the detection of antibodies to Brucella abortus in cattle sera and comparison to SAT, CFT, and iELISA. Journal of Immunological Methods. 278(1-2):1718. doi: 10.1016/S00221759(03)002011
Miranda KL, Cottorello ACP, Poester FP, Lage AP. 2005. Brucelose canina. En: Cadernos Técnicos de Veterinária e Zootecnia. Conselho Regional de Medicina Veterinária de Minas Gerais, Brasil (Editores). n.47, pp. 6682.
Moreno E. 2014. Retrospective and prospective perspectives on zoonotic brucellosis. Frontiers in Microbiology. 13(5):213. doi: 10.3389/fmicb.2014.00213
Nicola A, Elena S. 2009. Manual de diagnóstico serológico de la brucelosis bovina. Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA). Buenos Aires, Argentina. p. 95.
Nielsen K. 2002. Diagnosis of brucellosis by serology. Veterinary Microbiology. 90(14):44759. doi: 10.1016/S03781135(02)002298
Nielsen K, Smith P, Yu W, Nicoletti P, Elzer P, Robles C, Bermúdez R, Renteria T, Moreno FS, Ruiz A, Massengill C, Muenks Q, Jurgersen G, Tollersrud T, Samartino L, Conde S, Forbes L, Gall D, Perez B, Rojas X, Minas A. 2005. Towards single screening tests for brucellosis. Revue Scientifique et Technique. 24(3):102737.
Olsen SC, Palmer MV. 2014. Advancement of knowledge of Brucella over the past 50 years. Veterinary Pathology 51(6):1076–89. doi: 10.1177/0300985814540545
Pidgeon GL, Scanlan CM, Miller WR, Mayer TW. 1987. Experimental infection of dogs with Brucella abortus. The Cornell Veterinarian. 77(4):33947
Prior MG. 1976. Isolation of Brucella abortus from two dogs in contact with bovine brucelosis. Canadian Journal of Comparative Medicine. 40(1): 1178.
Ramamoorthy S, Woldemeskel M, Ligett A, Snider R, Cobb R, Rajeev S. 2011. Brucella suis infection in dogs, Georgia, USA. Emerging Infectious Diseases. 17(12):238687. doi: 10.3201/eid1712.111127
Robles, CA.1998. Evaluación de una técnica de doble difusión en gel de agar para el diagnóstico de la infección por Brucella ovis en carneros. Veterinaria Argentina. Vol XV(142):119-24.
Sandoval LA, Conrado Ribeiro LO, Amaral LBS, Feitosa MH, Bazan JM. 1976. Incidência da Brucelose canina na Cidade de São Paulo. Biológico, v.42, pp.12832.
Shin SJ, Carmichael L. 1999. Canine brucellosis caused by Brucella canis. En: Carmichael L. Ed. Recent advances in canine infectious diseases. Ithaca, IVIS (www.ivis.org) A0101.1199.
Uçan US, Aras Z. 2015. The “One Health” concept and a need for national monitoring of canine and feline infections. En: Proceedings of the 1st Turkish Congress of One Health. Konya, Turkey, pp. 61-2.
Vargas F. 2002. Brucellosis in Venezuela. Veterinary Microbiology. 90(14):3944. doi: 10.1016/S03781135(02)002432
Whatmore AM. 2009. Current understanding of the genetic diversity of Brucella, an expanding genus of zoonotic pathogens. Infection, Genetics and Evolution. 9(6):116884. doi: 10.1016/j.meegid.2009.07.001
Whatmore AM, Davison N, Cloeckaert A, Al Dahouk S, Zygmunt MS, Brew SD, Perrett LL, Koylass MS, Vergnaud G, Quance C, Scholz HC, Dick EJ Jr, Hubbard G, SchlabritzLoutsevitch NE. 2014. Brucella papionis sp. nov., isolated from baboons (Papio spp.). International Journal of Systematic and Evolutionary Microbiology. 64(12):41208. doi: 10.1099/ijs.0.0654820