



Potencial agroecológico de Crotalaria spp. como extracto vegetal en la agricultura
Agroecological prospects of Crotalaria spp. as a vegetable extract in agriculture
Revista de la Facultad de Agronomía
Universidad Nacional de La Plata, Argentina
ISSN: 1669-9513
Periodicidad: Semestral
vol. 121, núm. 2, 2022
Recepción: 29 Marzo 2022
Aprobación: 14 Septiembre 2022
Autor de correspondencia: jdelgado@conacyt.mx
Resumen: Las especies de Crotalaria están ampliamente distribuidas en climas tropicales y subtropicales, describiéndose más de 700 especies; de las cuales, la mayoría son consideradas malezas o especies invasoras. El objetivo de esta investigación fue establecer las características distintivas del género Crotalaria, diversidad genética, composición fitoquímica y su potencial aplicación en el control de enfermedades y usos en la agricultura. La investigación fue desarrollada a través de un estudio sistemático de artículos científicos consultados en diferentes bases de datos nacionales e internacionales; de los cuales se exploró la información desde aspectos botánicos, su diversidad genética, su actividad biológica y su aplicación como alternativa ecológica en la agricultura. Las plantas de este género presentan una amplia diversidad metabólica de compuestos bioactivos en semillas, raíces, tallos, hojas y flores; a partir de extractos acuosos, etanol, metanol, éter etílico, cloroformo y diclorometano, que muestran efecto directo o indirecto relacionado con actividades antidiarreicas, antiinflamatorias, cardiodepresores y como hepatoprotectores. También se ha demostrado la eficacia de extractos vegetales en la agricultura como manejo alternativo sobre agentes patógenos como bacterias, hongos, insectos, nematodos, en el control de malezas y su función como fuente de nutrientes.
Palabras clave: fitoquímica, biocida, metabolitos secundarios, malezas..
Abstract: The Crotalaria species occur widely in tropical and subtropical climates, with more than 700 species described, most of which are considered weeds or invasive species. The objective of this review was to establish the distinctive characteristics of the Crotalaria genus, genetic diversity, phytochemical composition and its potential application in the control of diseases and uses in agriculture. The research was developed through a systematic study of scientific articles consulted in different national and international databases; of which the information was explored from botanical aspects, genetic diversity, its biological activity and its application as an ecological alternative in agriculture. The plants of this genus present a wide metabolic diversity of bioactive compounds in seeds, roots, stems, leaves, and flowers; from aqueous extracts, ethanol, methanol, ethyl ether, chloroform, and dichloromethane, which show direct or indirect effects related to antidiarrheal, anti-inflammatory, cardiodepressor and hepatoprotective activities. Moreover, the efficacy of plant extracts in agriculture has shown their effectiveness as alternative management of pathogens such as bacteria, fungi, insects, nematodes in weed control and their function as a source of nutrients.
Keywords: phytochemistry, biocide, secondary metabolites, weeds.
Introducción
El género Crotalaria pertenece a la familia Fabaceae; las 700 especies registradas en este género predominantemente se desarrollan de manera silvestre; el 71% de estas especies se distribuyen en los países de Madagascar, Camerún, Nigeria y Senegal. El resto en territorios con climas tropicales y subtropicales (Argentina, Brasil, Colombia, Estados Unidos, Guatemala, México y Venezuela) (Mosjidis & Wang, 2011; Satya et al., 2016; Prada et al., 2020). Por otro lado, se han observado especies en países como Sri Lanka, Birmania, Pakistán (Wang et al., 2006), Haití (Lynch et al., 2016), la India (Colegate et al., 2012), Australia (Fletcher et al., 2009), Tailandia (Sutjaritjai et al., 2019) y China (Zhang et al., 2017). Se han reportado alrededor de 71 especies distribuidas en los Estados Unidos de Norte América, México, Guatemala, Uruguay, Brasil y Argentina; de las cuales 21 especies se presentan en México y nueve son consideradas endémicas (Salinas-Morales et al., 2022).
Este género es conocido coloquialmente como “caja de cascabel”, “vainas de sonajero” o “frijoles del diablo”, presentando frutos con abundantes semillas, que al secarse generan un sonido parecido a una sonaja o el sonido de una víbora de cascabel (Stegelmeier, 2011). Se ha observado que Crotalaria spp. se adaptan en praderas, pendientes y márgenes de bosques, con texturas de suelos arenosos o disturbados, en suelos que han perdido de manera parcial o total sus atributos de productividad o regulación hídrica por efecto de la tala, erosión eólica, inundaciones, expansión urbana, contaminación o por actividades agrícolas (Saboon et al., 2015).
Diferentes especies del género Crotalaria presentan una opción como fuente de alimento y como hortaliza alternativa con valor nutricional para la dieta humana ( Guerra-Centeno et al., 2016). Se ha demostrado su capacidad como forraje de animales, por mejorar el proceso de fermentación del rumen del ganado a partir de sus gomas y proteínas solubles (Wanapat et al., 2021); como abono verde para uso en suelos ácidos, ya que presenta la capacidad de fijar nitrógeno en suelos con sobre explotación agronómica (Mosjidis & Wang, 2011), como herbicidas e insecticidas en el área agrícola (Castañeda et al., 2017) y en la fitorremediación de suelos por asimilación o disminución mediante procesos biológicos (metabolismo de la planta), físicos (adsorción, filtración, sedimentación y volatilización) y químicos (hidrolisis o reacciones de óxido-reducción y precipitación), de compuestos provenientes de hidrocarburos de petróleo, plaguicidas, surfactantes, metales pesados (cobalto, cobre y cromo) y no metales (arsénico y boro) (Delgadillo-López et al., 2011; Gamage et al., 2020). También se ha usado en la medicina tradicional humana y para animales (Sutjaritjai et al., 2019).
Tomando en cuenta que las plantas del género Crotalaria producen diferentes metabolitos tanto primarios como secundarios como respuesta a condiciones abióticas y bióticas; se vuelven un potencial de estudio para su uso en la agricultura (Chavez et al., 2018). Se reportan compuestos fitoquímicos secundarios como alcaloides, esteroides, ácidos fenólicos, flavonoides, triterpenos, taninos y saponinas; diversas fuentes con valor nutricional como aminoácidos, aceites volátiles, carbohidratos, fibra dietética, glucósidos, proteínas, oligosacáridos y minerales (Rovira et al., 2019; Vergun et al., 2020). La función de dichos compuestos se encuentran relacionados de manera potencial como antiinflamatorio, donde en ensayos in vitro en ratones han generado estabilización de la membrana de los glóbulos rojos mediante la disminución en la desnaturalización de la albúmina (Govindappa et al., 2011), disminuyendo el dolor articular o los trastornos urinarios por la presencia de crotafuranos y pterocarpanoides (Bulbul et al., 2017). De igual forma un efecto antidiarreico mediante el control de parásitos del género Plasmodium (Bello et al., 2017) y como hepatoprotector con el bloqueo de compuestos tóxicos en el hígado de ratones (Al-Snafi, 2016; Miranda-Granados et al., 2018). También se han observado efectos antitumorales en células madre en ensayos in vitro, inducido por β-catenina, ciclooxigenasa 2 y ácido elágico (Devendra et al., 2012; Mateos-Maces et al., 2020; Sinan et al., 2020).
Además, se han presentado compuestos cardiodepresores que minimizan el daño cardiaco en ratones por el compuesto monocrotalina (Buyukakilli et al., 2014) y recientemente actividad nutracéutica con aportes a la dieta humana con proteínas, carbohidratos y fibra dietética (Mateos-Maces et al., 2020). Capacidad antioxidante presentando una buena estabilidad del radical 1,1-difenil-2-picrilhidrazil (DPPH) ( Suwanchaikasem et al., 2013; Al-Snafi, 2016; Sinan et al., 2020) e hipolipidémico al favorecer la disminución en niveles de colesterol total sérico en ratones (Al-Snafi, 2016). En la sanidad vegetal de cultivos de interés económico, como agente antibacteriano por la inhibición in vitro de Bacillus subtilis, Clavibacter michiganensis sub spp. michiganensis, Novosphingobium oryzae, Staphylococcus epidermidis, Pseudomonas sp., P. aeruginosa, P. fluorescens, Xanthomonas oryzae pv. oryzae y X. axanopodis pv. malvacearum; actividad antifúngica por el control in vitro de Alternaria carthami, A. helianthi, Aspergillus flaviceps, A. nidulans, Fusarium solani, F. oxysporum, Phytophthora capsici, Colletotrichum capsici, Rhizoctonia solani y F. verticilloides, este último evaluado in vivo (Govindappa et al., 2011; Al-Snafi, 2016; Cruz-Rodríguez et al., 2020).
Gomes et al. (2005) observaron actividad insecticida a partir de la ingesta de semillas de C. pallida sobre Alabama argillacea, Anthonomus grandis, Callosobruchus maculatus, Ceratitis capitata, Spodoptera frugiperda y Zabrotes subfasciatus; mediante la inhibición del sitio activo de la enzima tripsina, la cual está involucrada en la asimilación de aminoácidos para el crecimiento y supervivencia del insecto.
Por lo anterior, el objetivo de este trabajo fue establecer las características distintivas del género Crotalaria, su diversidad genética, composición fitoquímica y su potencial aplicación en el control de enfermedades y usos en la agricultura. La investigación fue desarrollada a través de un estudio sistemático de artículos científicos consultados en diferentes bases de datos nacionales e internacionales; de los cuales se exploró la información desde aspectos botánicos, diversidad genética, su actividad biológica y su aplicación como alternativa ecológica en la agricultura.
Descripción botánica de Crotalaria spp.
Son plantas herbáceas del tipo anual o perenne, de porte arbustivo o herbáceo (Guerra-Centeno et al., 2016), se desarrollan regularmente por debajo de los 2,000 m.s.n.m. (Peñaloza & Pelaez, 2008) y temperaturas entre los 16 y 32°C (Rovira et al., 2019). Crecimiento de tallo erecto, base leñosa en algunos casos (Figura 1a), altura desde 0,34 m hasta 2,65 m, coloración verde oscuro y amarillo verdoso (Figura 1b) (Muli et al., 2021), tallos del tipo estriados, glabros, teretes, pubérulos, tomentosos, pilosos y pubescentes. Hojas simples o compuestas trifoliadas o alternas (con folíolos lanceolados, lineares, elípticos, oblongos, oblanceolados, ovadas, linear-oblongos, elíptico-obovados o lanceolados), con bordes del tipo entero, pubescentes o glabros, estípulas (decurrentes, libres, persistentes o caducas) y cara adaxial con o sin puntos glandulares (Figura 1c) (Avendaño, 2011; Kay, 2017) con un promedio de 3 a 34 ramas, área foliar desde 0,606 a 122,51 cm. aproximadamente (Muli et al., 2021). Las inflorescencias pueden ser simples, axilares, terminales, racemosas u opuestas a la hoja (paucifloras, multifloras uni o bifloras) de uno a tres flores (Figura 1d); se pueden presentar o no brácteas en la base del cáliz o sobre el pedicelo, con coloración amarilla en el exterior y rojo en la parte interna (Avendaño, 2011; Thomas et al., 2012; Bussmann et al., 2021). Las flores pueden medir de largo entre 0,2 a 1,5 cm, son zigomorfas, hermafroditas, normalmente de cinco lóbulos largos (glabro o pubescente), corola usualmente amarilla con rayas papilionácea (puede presentarse listas rojas, manchas rojo-violáceas o azul-violácea) (Figura 1e), con tricomas ciliados en el margen de los pétalos, principalmente estambres monadelfos, el tubo se presenta abierto en la parte superior, anteras dimórficas (cinco dorsifijas pequeñas y cinco basifijas grandes), el ovario es multiovulado (estilo curvado o genicular en la base, ya sea glabro o pubescente) (Le Roux & Van Wyk, 2012).
Se presenta una cantidad abundante de semillas, impermeables al agua, testa dura y lisa (Garduza et al., 2020), en forma oblicua, reniforme, estipitadas y se presenta un fruto en forma de legumbre (cilíndrica, linear oblongo-globoso), gradualmente se estrechan en el estípite, aproximadamente 3 a 7 cm de largo y 0,5 a 1,5 cm de ancho, coloración amarillo pálido, rojo anaranjado, grises, mezcla de los colores anteriores y negro al madurar (figura f) (Avendaño, 2011; Bussmann et al., 2021). Las paredes de las frutas en la tribu Crotalarieae se presentan de forma 1) tipo crotalaria (capas variadas lignificadas), 2) tipo Listia (combinación de células epicarpicas grandes y lignificadas en única capa) y 3) tipo Calobota (células lignificadas pequeñas de capas delgadas y múltiples) (Le Roux et al., 2010). Vainas pilosas, peludas, anchas en algunos casos, largas, suaves, delgadas ocasionalmente, lisas, coloración negra o marrón con rayas negras, presentes con una longitud promedio de 0,4 a 6,7 cm, diámetro de 2,28 a 6,83 cm (Muli et al., 2021).

El proceso reproductivo en el género Crotalaria normalmente se presenta de manera sexual a partir de semillas generadas en frutos, sin embargo, a pesar del gran número de flores por inflorescencias los frutos formados son bajos por el aborto a los dos días después de la antesis (siendo una estrategia de la planta para generar frutos de buena calidad y puedan acceder a los nutrientes necesarios) (Villalobos & Ramírez, 2010). Además, aprovecha un sistema mixto de apareamiento por xenogamia facultativa mediante el mecanismo de cepillo, consiste en la ruptura espontánea de la antera para exponer el polen y se acumule en la punta del pétalo de la quilla a fin de estar disponible para depositarse en el cuerpo del polinizador (Subramaniam et al., 2013). Las especies de insectos polinizadores que se han observado en plantas como C. juncea son del orden Hymenoptera (nueve especies), Lepidoptera (dos especies), Coleoptera (dos especies) y Diptera (una especie), siendo las hembras las más competentes en la recolección de néctar y polen (Rakesh et al., 2019).
Especies más reconocidas del género Crotalaria
En Brasil se describen 31 especies nativas y 11 especies exóticas clasificadas por las características de sus flores (Scupinari et al., 2020). La especie más representativa y reportada es C. juncea, una planta tropical llamada cáñamo solar originaria de regiones de África del sur, India, Sri Lanka y Nepal, de polinización cruzada (Wang et al., 2006), especie diploide anual de crecimiento acelerado. Se destina principalmente para la elaboración de cordeles, cuerdas, redes de pesca, papel moneda y de cigarrillos, así como mejorador de suelo como abono verde (aportando nitrógeno) (Tripathi et al., 2013). Para el uso en la erosión de suelos, control de malezas mediante la competencia de recursos y para el manejo de nematodos como cultivo trampa y barrera física (Zhang et al., 2017). De igual forma como forraje de uso restringido, posible uso como biocombustible (Prasad et al., 2013), usos culinarios y medicinales (para la anemia, psoriasis y depurativo sanguíneo) (Dinakaran et al., 2011).
C. retusa es un arbusto anual, semiperenne con ciclo corto de cinco meses, con origen en África, Asia y Australia; con una altura promedio de un metro, se adapta a diferentes humedades ambientales por lo que es considerada una maleza nociva; presenta polimorfismo somático (De Figueiredo & Silva, 2018); de sabor amargo, astringente (Dhole et al., 2011). También es capaz de realizar simbiosis con bacterias fijadoras de nitrógeno; empleada para usos medicinales (como fiebre, antiespasmódico, diarrea), antitumoral, cardiodepresivo; como agente contra insectos herbívoros; pero es tóxico y venenoso para ganado bovino (Ogunsusi et al., 2018). Por otra parte, en países como Nigeria se utilizan para la alimentación de cabras y ovejas (Yashim et al., 2017).
La especie C. pallida se desarrolla en regiones de la India y Bangladesh, es anual, erecta de 1,5 m de altura con el tallo fibroso, crecimiento en zonas áridas y semiáridas; las semillas de esta planta se utilizan como alternativa del café. En medicina tradicional es utilizada en personas con problemas de inflamación de articulaciones, trastornos urinarios, antitumoral, antioxidante, antimicrobiano y efecto antinociceptivo (Bulbul et al., 2017). Además, se utiliza como analgésico para uso en seres vivos; como abono en cultivos de Camellia sinensis, Ficus elastica y Cocos nucifera, presentando compuestos como alcaloides, flavonoides, taninos, terpenos, saponinas, compuestos fenólicos y como posible promotor de hidroxiprolina (Ukil et al., 2016; Kamath et al., 2017). Sin embargo, es tóxica para cabras, caballos, cerdos, ovejas, pollos y ratas (Diaz et al., 2014).
C. spectabilis es una especie que se ha encontrado en regiones subtropicales y tropicales, en la India, Asia, Australia, Cuba y Nueva Caledonia; es un arbusto anual erecto; con una tasa alta de producción de semillas (16,327 en promedio); considerada como una maleza; puede encontrarse en suelos erosionados, manglares, principalmente en altitudes de 1,500 m.s.n.m., contenido alto en alcaloides pirrolizidínicos en semillas; teniendo en cuenta que es tóxico para ganado vacuno, cabras, perros, aves y codornices ( Rojas-Sandoval, 2016; Kar & Datta, 2018). Es aplicado como abono verde, disminuye la incidencia bacteriana en suelos agrícolas (Deberdt et al., 2014); de forma similar presenta efecto antiinflamatorio, desintoxicación, antioxidante, hepatoxicidad en humanos y animales (Suwanchaikasem et al., 2013).
La mayoría de las especies de Crotalaria presentan características muy similares, por lo que identificar plantas nativas silvestres o semidomesticadas es importante. En México la especie más conocida es C. longirostrata, que está catalogada como un quelite, la cual se desarrolla en áreas naturales y en comunidades indígenas del sureste del país (Mateos-Maces et al., 2020). Conocida como chipilín, C. longirostrata es nativa de América Central y México, se desarrollan de manera silvestre, de 1,5 m de altura, en suelos arenosos, francos arcillosos, presente hasta 1,960 m.s.n.m. En particular muestra un contenido alto de flavonoides, compuestos fenólicos, minerales (Ca, K, Mg, P, Fe), vitamina B1 y vitamina C y actividad antioxidante (Jiménez & Grusak, 2015; Rovira et al., 2019; Navarro-Flores et al., 2020). Tradicionalmente es utilizada en el arte culinario en la dieta de las personas y las hojas se consumen para tratar la anemia. Se cultiva como hortaliza y abono verde en zonas agrícolas, como forraje para animales y en la elaboración de papel (Arias et al., 2003; Cruz-Rodríguez et al., 2020).
Recursos genéticos del género Crotalaria
Los estudios genéticos clásicos son muy escasos en Crotalaria, la tipificación de la variación del número de cromosomas fundamentales entre las especies puede contribuir a la explicación de su evolución y disparidad por especiación. La tribu a la que pertenece el género Crotalaria es monofilético y cercano a la tribu Genistaeae. Crotalaria spp. presenta cromosomas 2n= 16, en especies americanas subsección Incanae se reportan 2n= 32 (poliploides) y en especies del conjunto Chrysocalycinae subsección Incanae 2n= 14 (Mosjidis & Wang, 2011). A partir del análisis del complejo nucleoproteico NOR-heterocromatina, el cariotipo por banda C manifestó dos constricciones secundarias en la región distal del cromosoma 1 y la región proximal del cromosoma 4, confirmándose por el 45S ADNr y el 5S ADNr (hibridación fluorescente in situ). Expresando que los tipos de heterocromatina demuestran la existencia de ordenamiento dentro de la familia Fabaceae a partir del ADNr repetido en bloques heterocromáticos al momento de la multiplicidad de especies, por eventos de transposición o la variabilidad en los cruces (Mondin & Aguiar-Perecin, 2011).
La evaluación de la diversidad genética para lograr examinar las relaciones filogenéticas del germoplasma de este género se ha obtenido de información de un marcador de secuencia expresada (EST: Expressed Sequence Tag, por sus siglas en inglés) manejando una repetición de secuencia simple (SSR) codominante, con alto polimorfismo y buena repetibilidad. Sin embargo, requieren mucho tiempo para su desarrollo, poca probabilidad de éxito, con una tasa de clonación positiva relativamente baja y costos altos (Hou et al., 2017). El uso de EST-SSR a partir de accesiones permitieron la identificación de 18 especies de C. juncea, cuatro especies de C. spectabilis, tres especies de C. retusa y dos especies de C. pallida por medio de modelos de plantas de Medicago sativa y Glycine max para legumbres de clima cálido, la funcionalidad de alelos superiores utilizando EST-SSR para determinar los polimorfismos interespecíficos para evaluar la diversidad genética, amplificando 200 pb para especies menores de la familia de las fabáceas en la cual existe muy poca información genómica, donde se reclasificaron dos especies (C. spectabilis y C. juncea) al grupo de C. retusa (Wang et al., 2006).
Mediante estudios filogenéticos de variaciones en las proteínas de semillas se identificaron clados de especies de C. grahamiana, C. pallida, C. laburnifolia, C. retusa, C. beddomeana, C. verrucosa, C. paniculata, y C. juncea, empleando el método de análisis de distancias genéticas de Nei´s. El cual revelo los patrones de diferentes proteínas de lectina para generar el intervalo de subespecies de Crotalaria, obteniéndose dendrogramas de similitudes genéticas entre individuos y análisis de componentes principales para la individualización morfológica de cada especie, demostrando que las similitudes son bajas y la heterocigosidad en el locus expresa poca asociación con subespecies conocidas (Raj et al., 2011).
La identificación de la especie C. spectabilis utilizando patrones estándar de Crotalaria spp. mediante la restricción de la enzima DdeI a partir de la reacción en cadena de la polimerasa y fragmentos de restricción de longitud polimorfica (PCR-RFLP) con los cebadores matK-465F y matK-1483R. Se logró una amplificación de 1 kb aproximadamente con el gen matK del cloroplasto obteniendo fragmentos de 230 pb y 807 pb, que facilitaron la diferenciación en los sitios variables (Suwanchaikasem et al., 2013).
De igual forma, se utilizó la técnica de código de barras con la finalidad de identificar especies destinando fragmentos cortos y estandarizados del genoma, combinando con un análisis de fusión de alta resolución (Bar-HRM) lo que generó una tipificación de los cambios de base única o diferencias determinadas para la identificación taxonómica de especies de una región corta del ADN. La identificación por esta técnica fue propuesta para la planta C. spectabilis a partir de las secuencias de dos regiones de plastidios locus trnL, donde se observó una adecuada identificación de la especie cuando se concibió una longitud aparente de 300 pb o menos, siendo un método rápido y sensible para diferenciar entre especies, de bajo costo y cuando se cuenta con datos limitados de regiones del ADN (Singtonat & Osathanunkul, 2015).
Composición nutricional de Crotalaria
El contenido nutrimental de hojas de C. longirostrata, reportó que por cada 100 gramos de peso fresco aportan 56 calorías, 9,1 g de carbohidratos, 0,8 g de grasa, 7 g de proteína y 2 g de fibra (Guerra-Centeno et al., 2016). En un gramo de muestra fresca contiene el 86,8% de agua, vitamina C (1,0-2,48 mg.g-1), fenoles (2,68-3,38 mg.g-1), flavonoides (115,73-178,88 µg.g-1 equivalentes de catequina) y actividad antioxidante (52,16-60,47 μmol.g-1 equivalentes de Trolox) (Jiménez & Grusak, 2015). En hojas secas se reporta un 2,1% extracto etéreo, 8,2% fibra cruda, 51,7% proteína cruda, 7,9% ceniza y 30% de extracto libre de nitrógeno (Guerra-Centeno et al., 2016). En cuanto a las fracciones de fibra presente en hojas de C. longirostrata se identificó el 11,1% de celulosa, 8,9% de hemicelulosa y el 35,3% de digestibilidad in vitro de materia seca (Arias et al., 2003). Además, el contenido de minerales en un gramo de muestra fresca de C. longirostrata presenta azufre (0,15-1,02 µg.g-1), boro (0,47-0,88 µg.g-1), calcio (0,82-2,18 mg.g-1), cobalto (0,01-0,02 µg.g-1), fósforo (0,27-0,61 mg.g-1), hierro (5,69-13,38 µg.g-1), potasio (1,61-2,94 mg.g-1), magnesio (0,61-1 mg.g-1), manganeso (4,11-8,15 µg.g-1), níquel (0,10-0,19 µg.g-1), sodio (0,56-1,50 µg.g-1) y zinc (4,06-7,21 µg.g-1) (Jiménez & Grusak, 2015). Finalmente, se descubrió que C. longirostrata proporciona aminoácidos esenciales en concentraciones de 1,7 a 6,7 g por cada 100 g de proteína, siendo la arginina, isoleucina, histidina, lisina, leucina, treonina y valina los principales (Mateos-Maces et al., 2020).
Fitoquímica de Crotalaria spp
En especies del género Crotalaria se ha documentado la presencia de metabolitos secundarios en semillas, raíces, tallos, hojas y flores (Prada et al., 2020). A través de estas estructuras químicas se desempeñan funciones ecofisiológicas que generan una defensa ante los factores ambientales (bióticos y abióticos). Funcionando dichos metabolitos secundarios en la planta de manera acumulativa y sinérgica para generar una actividad como repelentes, herbicidas, inhibidores de herbívoros, antivirales, antifúngicos y antimicrobianos. Por lo que su uso en la agricultura se plantea como bioplaguicidas (Geilfus, 2019).
Los metabolitos secundarios descritos actualmente de diferentes familias de plantas se han agrupado según su composición, alrededor de 5,710 estructuras con nitrógeno (alcaloides, aminoácidos no proteicos, aminas, amidas, glúcidos cianogénicos, glucosinolatos, lectinas y péptidos antimicrobianos), 22,800 sin nitrógeno (antocianinas, cumarinas, diterpenos, esteroides, fenoles, flavonoides, fenilpropanoides, terpenos, triterpenos, tetraterpenos, monoterpenos, sesquiterpenos, saponinas, lignanos, taninos, policétidos y antraquinonas) y de diferente composición 2,100 (ácidos orgánicos, carbohidratos y poliacetilenos) (Geilfus, 2019). A continuación, se observa en la Tabla 1 un registro de los metabolitos secundarios presentes en el género Crotalaria spp; sin considerar el solvente de extracción de los mismos.
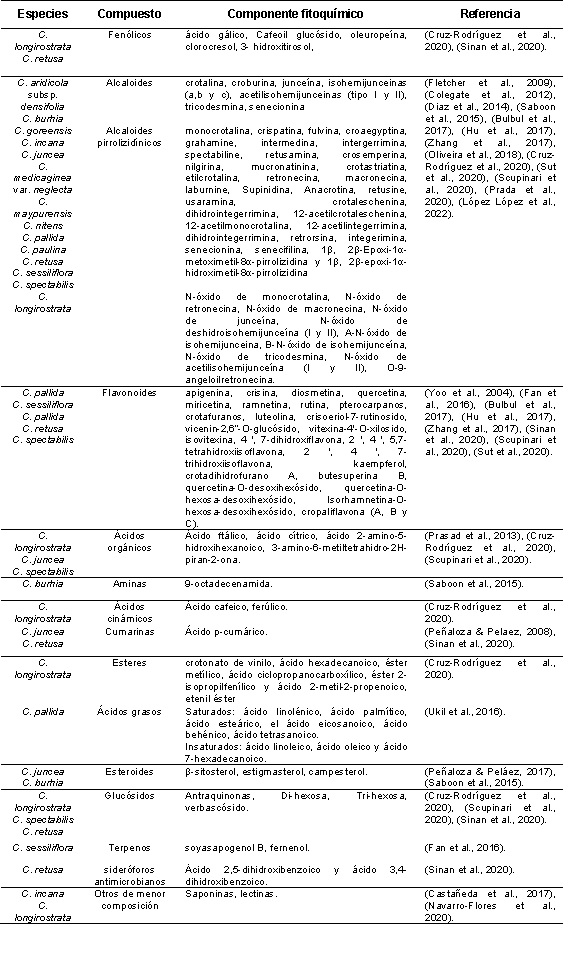
Derivado de varios análisis fitoquímicos a partir de la extracción con metanol se reportan en Crotalaria spp. la presencia de flavonoides hasta un 12,45 mg.g-1 de hoja equivalentes a rutina (Zhang et al., 2017; Sinan et al., 2020; Sut et al., 2020). Se ha observado la capacidad de absorbancia de radicales de oxígeno (ORAC), capacidad antioxidante equivalente a Trolox (TEAC) de extractos generados de diferentes especies de Crotalaria (Mateos-Maces et al., 2020). Algo similar resultó del extracto metanólico de C. retusa donde se obtuvieron alcaloides, los cuales fueron aplicados en hojas de Phaseolus vulgaris, desencadenando una mayor actividad antioxidante de las enzimas catalasa y superóxido dismutasa, mayor presencia de ácido ascórbico, glutatión reducido y la prolina (Ogunsusi et al., 2018). En otro ensayo sobre C. retusa, el contenido fitoquímico del extracto metanólico presentó 32 compuestos con el potencial para la elaboración de bioproductos farmacéuticos (tratamiento para la diabetes tipo II, enfermedad de Alzheimer y dermatológicos) y en la agricultura (actividad biocida) (Sut et al., 2020).
Actividad biocida
Plantas del género Crotalaria exhiben compuestos con actividad contra insectos, bacterias, hongos y nematodos (Vergun et al., 2020). La obtención de extractos de hojas, flores, ramas maduras y raíces de la planta pueden incluir una amplia gama de metabolitos que desplieguen un control de organismos nocivos para el ser humano o de plantas (Oliveira et al., 2020).
El análisis fitoquímico de los extractos acuosos y etanólicos de C. retusa manifestaron la presencia de alcaloides, esteroides, flavonoides, saponinas y taninos, dichos compuestos presentaron actividad antimicrobiana a una concentración de 750 µg.mL-1 en Bacillus subtilis, Staphylococcus aureus y Aspergillus niger, inhibiendo el 13%, 25% y 9% respectivamente (Dhole et al., 2011). En el estudio in vivo del cultivo de tomate Roma para el control de Ralstonia solanacearum, fue establecido previamente la especie C. spectabilis como cultivo, al terminar su ciclo se estableció el siembra de tomate lo que manifestó un saneamiento del suelo, una mejora en el rendimiento del fruto de tomate y menor incidencia de la bacteria del 64% a los 28 días después del trasplante (Deberdt et al., 2014). De igual forma el ensayo a partir de aceite obtenido de hojas de C. pallida presento abundancia de los ácidos grasos linoleico, linolénico y oleico, manifestando actividad bactericida sobre Acinetobacter junii, B. subtilis y E. coli, en concentraciones de 10 µg.mL-1, 80 µg.mL-1 y 10 µg.mL-1 respectivamente (Ukil et al., 2016).
El análisis fitoquímico de hojas de la planta C. longirostrata a partir de un extracto acuoso, presentó actividad fungistática en un lapso de 96 h sobre Fusarium sp. con 31%, F. solani 21%, F. oxysporum del 27%, para la fracción procedente de éter etílico presentó únicamente actividad antibacteriana sobre S. epidermidis logrando un control del 27% (Miranda-Granados et al., 2018).
También se ha observado actividad antifúngica del género Crotalaria a partir de extractos que han demostrado inhibición del crecimiento micelial e inhibición de la esporulación; en el estudio de C. longirostrata a partir del extracto metanólico de tallos generó un 64% del crecimiento micelial y 66% de inhibición de la esporulación sobre Fusarium sp., el extracto metanólico de las raíces un 71% del crecimiento micelial e inhibición de la esporulación para F. verticillioides y los extractos metanólicos de tallos, ramas y raíces inhibieron en un 90% del crecimiento micelial e inhibición de la esporulación sobre el hongo A. flavus. El análisis fitoquímico demostró la presencia de compuestos flavonoides, isoflavonoides, alcaloides, triterpenoides, fenilpropanoides, antraquinonas, cumarina, glucósidos cianogénicos y proteasas inhibidoras que podrían ser los responsables de dicha actividad biocida (Cruz-Rodríguez et al., 2017). De lo anterior resultó un ensayo in vivo para el control de Fusarium verticillioides en el cultivo de Zea mays, mediante el manejo del extracto crudo de ramas de C. longirostrata. Obteniéndose una disminución en la severidad en un 30% y la incidencia un 11%. Igualmente se reporta la identificación y cuantificación de los metabolitos secundarios con mayor abundancia como compuestos fenólicos (ácido gálico), ácidos cinámicos (ácido cafeico) y el alcaloide pirrolizidínico monocrotalina; posibles responsables de la acción fungistática (Cruz-Rodríguez et al., 2020).
Existen reportes sobre el control de juveniles de Meloidogyne arenaria, M. incognita y M. javanica, a través de extractos acuosos, pulverizados y como cultivos de cobertura; plantas de C. atrorubens, C. lathyroides y C. grantiana; de lo anterior resulta la disminución en la persistencia del nematodo desde un 50%, 70% y 38% respectivamente (Rodríguez et al., 2007). Se ha demostrado también el control de Meloidogyne sp. utilizando a Crotalaria sp. como cobertura en el suelo en invernadero para el cultivo de Solanum quitoense, generando un efecto nematostático del 15%, mediante los compuestos alelopáticos y volátiles producidos por Crotalaria sp. (Betancourth et al., 2011). Para el control de Radopholus similis en el cultivo de Musa acuminata Colla c.v. Grande Naine con la siembra de C. spectabilis como cultivo intercalado, lo que generó un aumento del 19% del peso fresco de la raíz y disminuyó la presencia de estados juveniles del nematodo en un 49%, en hembras un 51% y machos el 7%. Este efecto se asocia a la presencia de alcaloides que produce C. spectabilis, desencadenando una respuesta sistémica inducida en las raíces de Musa acuminata, también se obtuvo información de la simbiosis con hongos micorrícicos que ejercen una actividad nematistática (Anene & Declerck, 2016).
El compuesto usaramina presente en semillas de C. pallida demuestra actividad biológica contra Drosophila melanogaster, presente en el extracto de diclorometano con una CL50 de 156,47 ppm en larvas y 7,95 ppm en pupas (Peñaloza & Peláez, 2014). A partir de semillas de C. juncea se obtuvo un extracto de éter de petróleo que contenía el metabolito estigmasterol el cual tiene efecto insecticida en pupas de D. melanogaster bajo condiciones in vitro; del cual se obtuvo una disminución del 42% y una CL50 de 178,8 ppm (Peñaloza & Peláez, 2017).
Recientemente, se reportó que el extracto metanólico de C. longirostrata presentó la capacidad de generar mortalidad de un 90,2% en ninfas del 4to instar de Bactericera cockerelli (Sulc.), con una CL50 de 4,78 mg.mL-1 en concentraciones de 16 mg.mL-1 a las 48 h. Atribuyéndose el efecto insecticida al compuesto 1β, 2β-Epoxi-1α-metoximetil-8α-pirrolizidina (un alcaloide de pirrolizidina), identificado por primera vez en esta especie; podría estar afectando las membranas celulares de los insectos, las conexiones neuronales y el tracto gastrointestinal (López-López et al., 2022).
Usos alternativos
Parte de los usos establecidos para Crotalaria es la fitorremediación de suelos mediante el manejo de herbicidas como el diclosulam (triazolopirimidinas). Bajo condiciones experimentales en invernadero se cultivaron plantas de C. ensiformi, C. breviflora y C. juncea, donde se observó a los 45 días después de la siembra una disminución en la concentración del herbicida del 10%, 98% y 47% respectivamente (Monquero et al., 2013). Se ha evaluado la reducción de los niveles de la contaminación de aceites lubricantes de uso cercano a zonas agrícolas mediante cultivos trampa con C. retusa, presentando a los 90 días después de la germinación una acumulación de biomasa del 2% p.p-1, un desarrollo positivo de la rizosfera cercana al tallo y sin cambios negativos en los parámetros agronómicos de C. retusa (longitud de la raíz, longitud del tallo, altura de los brotes, nódulos radiculares, biomasa seca de raíz y tallo) (Gamage et al., 2020).
A través de experimentos realizados en invernadero en Zea mays y Phaseolus vulgaris, se ha podido establecer la capacidad de C. juncea en el aumento en la disponibilidad de carbono en un 80% y mineralización de nitrógeno en un 85%, a los 112 días después de la incorporación en el sustrato (Lynch et al., 2016). El empleo de C. juncea ha demostrado su aporte como abono verde cuando se manipula triturado y como complemento con la fertilización inorgánica en Zea mays, aumentando el rendimiento hasta un 17% (Subaedah et al., 2016). De igual manera se reporta una mejora en el manejo de pasto forrajero Brachiaria brizantha cv. Piatá incorporando al suelo como rastrojo partes de la planta C. spectabilis, dando un incremento del 15% en nitrógeno y 47% de materia orgánica (Chavez et al., 2018).
En el cultivo de Solanum lycopersicum variedad Río Grande se manejó hojas de C. retusa en polvo, lo que generó un aumento en la biomasa de la raíz en un 45% y el extracto de acetato de etilo aplicado de manera foliar incrementó el diámetro del tallo en 11%, mientras que los parámetros de tasa de aborto de flores, número de flores por racimo, número de racimos por planta, biomasa de hojas, frutos y de tallo se mantuvieron (Schinzoumka et al., 2016).
El empleo de C. longirostrata para usarse como hortaliza de consumo alternativo para humanos, demostró la capacidad de reducir el uso de nitrógeno inorgánico en la nutrición del ciclo de cultivo hasta un 80 Kg.ha-1, actividad simbiótica con la rizobacteria Rhizobium leguminosarum biovar logrando incrementar el peso fresco total del cultivo en 158 Kg.ha-1, así mismo, se logró un aumento en la producción total de 800 Kg.ha-1 (Camarillo & Mangan, 2020).
El control de malezas Amaranthus hybridus, Senna obtusifolia y Lolium multiflorum tratando con residuos secos y molidos de .. juncea para aprovechar el efecto de los compuestos químicos alelopáticos (fenoles, flavonoides, alcaloides y taninos) mediante el ensayo in vivo durante 65 días después de la germinación, obteniendo una disminución en la germinación en todas las malezas hasta por 14 días y una disminución del 44% en el desarrollo (Skinner et al., 2012).
La evaluación del potencial de las hojas de chipilín como fuente proteica en tilapia nilótica (Oreochromis niloticus) se expresó positivamente en el aporte al peso y talla, incluyendo en la formulación de la dieta un 20 y 40% de la biomasa de hojas frescas por un periodo de 30 días, sin observar efectos negativos en la supervivencia de los peces, pero si se suministran concentraciones de 60 a 80% induce pérdida de peso (Guerra-Centeno et al., 2016).
Las especies C. spectabilis, C. pallida y C. retusa se han utilizado para obtener fibra, cultivos protectores del suelo y controlar malezas (Pandey et al., 2010). Otras especies tolerantes a sequía empleadas como ornamentales y plantas medicinales para humanos son C. nana Burm f., C. laburnifolia y C. verrucosa (Satya et al., 2016).
Conclusión
Los metabolitos secundarios identificados en Crotalaria spp. (Tabla 1) y las investigaciones publicadas reflejan una falta de conocimiento en la aplicación para el control de plagas y enfermedades implementados a través de extractos vegetales. Sin embargo, existe un interés creciente por la posible inducción de resistencia en diversas rutas metabólicas, lo que se traduce en una reducción de los costos energéticos para las plantas en las que se aplican. Ocasionando respuestas defensivas rápidas, orientadas espacial y temporalmente; también puede cumplir con los requisitos de seguridad ambiental, toxicológica, condiciones fáciles de usar para su producción y uso en áreas agrícolas de una manera económicamente justificada (Delgado-Oramas et al., 2020). Estos enfoques de baja tecnología para obtener extractos de plantas demuestran funciones similares a los pesticidas sintéticos; reduciendo las poblaciones de plagas y las infestaciones de cultivos, al tiempo que aumentan los rendimientos, disminuyen los riesgos para la salud humana y los organismos benéficos.
Esta revisión muestra evidencias de las especies más estudiadas del género Crotalaria, las cuales representan una opción eficaz para adquirir metabolitos secundarios, obtenidos de polvos y extractos vegetales (en disolventes como agua, acetona, etanol, éter etílico, hexano, cloroformo, diclorometano y metanol). Como resultado, se han identificado alcaloides pirrolizidínicos con mayor abundancia, seguido de flavonoides, ácidos grasos, compuestos fenólicos, esteres, ácidos orgánicos, ácidos cinámicos, esteroides, glúcidos y terpenos, que proporcionan una buena actividad ante los principales organismos fitopatógenos. Esto podría deberse al mecanismo de acción complejo y sinérgico cuando interactúan sus múltiples metabolitos en una actividad biocida sobre bacterias, insectos, hongos y nematodos. Algunos estudios demuestran su actividad para absorber, tolerar, acumular y degradar compuestos contaminantes en suelos agrícolas; el uso como abono verde principalmente como fuente de nitrógeno en diversos cultivos; en menor actividad para el control de malezas y como fuente proteica de animales. Finalmente, el potencial del género Crotalaria para usos agrícolas es prometedor, ya que pueden añadirse en los programas de manejo integrado de plagas.
Referencias
Al-Snafi, A.E. (2016). The contents and pharmacology of Crotalaria juncea-A review. IOSR Journal Of Pharmacy 6(6): 77–86.
Anene, A. & S. Declerck. (2016). Combination of Crotalaria spectabilis with Rhizophagus irregularis MUCL41833 decreases the iompact of Radopholus similis in banana. Applied Soil Ecology 106: 11–17.
Arias, L.; J. Cortes; A. Grande; J. Losada; H. Rendon; J. Rivera; R. Soriano & D. Vieyra. (2003). Evaluación de Chipilín (Crotalaria longirostrata) como recurso forrajero para la alimentación de rumiantes en las zonas tropicales de México. Investigación Ganadera para el Desarrollo Rural 15(4). Disponible en https://www.lrrd.cipav.org.co/lrrd15/4/aria154.htm. Ultimo acceso: octubre de 2021.
Avendaño, N. (2011). Revisión taxonómica del Género Crotalaria L. (Faboideae-Crotalarieae) en Venezuela. Acta Botanica Venezuelica 34(1): 13–78.
Bello, O.M.; Z. Ali; P.S. Fasinu; I.A. Khan; S.I. Khan; A.A. Zaki; O.S. Oguntoye & L.A. Usman. (2017). Assessment of selected medicinal plants indigenous to West Africa for antiprotozoal activity. South African Journal of Botany 113: 200–211.
Betancourth, G.C.; M. Rodríguez & G.C. Salazar. (2011). Evaluación de coberturas de suelo con caléndula (Calendula officinalis L.), Crotalaria (Crotalaria sp. L.) y avena (Avena sp. L.) En el control de Meloidogyne Spp. En lulo (Solanum quitoense Lam.). Revista de Ciencias Agrícolas 28(2): 43–57.
Bulbul, I.J.; S.B. Fashiuddin; M.R. Haque; M.A. Rashid & M.Z. Sultan. (2017). Anti-nociceptive and Anti-inflammatory Activities of Crotalaria pallida Aiton (Fam: Fabaceae) Leaves. Bangladesh Pharmaceutical Journal 20(2): 165–171.
Bussmann, R. W.; G. N. Njoroge & N.Y. Paniagua-zambrana. (2021). Crotalaria agatiflora Schweinf. Crotalaria fascicularis Polhill Crotalaria incana L. Crotalaria natalitia Meisn. Fabaceae. En Bussmann R.W. (eds) Ethnobotany of the Mountain Regions of Africa. Ethnobotany of Mountain Regions. Springer, Cham. pp. 351–356.
Buyukakilli, B.; D. Citirik; S. Gurgul; O. Hallioglu; M. Ozeren & B. Tasdelen. (2014). Determination of the effects of pulmonary arterial hypertension and therapy on the cardiovascular system of rats by impedance cardiography. Croatian Medical Journal 55(5): 498–506.
Camarillo, C.F. & F.X. Mangan. (2020). Biological nitrogen fixation in chipilin (Crotalaria longirostrata Hook. & Arn.), a sustainable nitrogen source for commercial production. Revista Chapingo Serie Horticultura 26(2): 125–141.
Castañeda, R.; É. Carrillo; H. Gutiérrez & A. Sotelo. (2017). Leguminosas (Fabaceae) silvestres de uso medicinal del distrito de Lircay, provincia de Angaraes (Huancavelica, Perú). Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 16(2): 136–149.
Chavez, G.E. de J.; R.P. Brenes & C.W. Peña. (2018). Aporte de materia orgánica de Crotalaria spectabilis Roth, en un suelo sembrado con Brachiaria brizantha cv. BRS piatá. Repertorio Científico 21(1): 1–8.
Colegate, S.M.; J.M. Betz; D.R. Gardner; R.J. Joy & K.E. Panter. (2012). Dehydropyrrolizidine alkaloids, including monoesters with an unusual esterifying acid, from cultivated Crotalaria juncea (Sunn Hemp cv.’Tropic Sun’). Journal of Agricultural and Food Chemistry 60(14): 3541–3550.
Cruz-Rodríguez, R.I.; S.A. Cruz; A.H.A. Esquinca; G.R. Meza; V.J.I. Pérez & L.N. Ruiz. (2020). Potential Application of Crotalaria longirostrata Branch Extract to Reduce the Severity of Disease Caused by Fusarium. Agronomy 10: 524.
Cruz-Rodríguez, R.I.; C.C. Arias; M.M.E. Ávila; T.T.R. Ayora; R.M. Culebro; M.F.A. Gutiérrez; M.N.A. Mancilla; G.R. Meza; M.M.A. Rodríguez & V.V.M. Ruiz. (2017). Antifungal activity of Crotalaria longirostrata Hook & Arn. extracts against phytopathogen fungi from maize. Gayana Botanica 74(1): 167–175.
De Figueiredo, P. S. & L.N.M. Silva. (2018). Somatic Polymorphism Variation in Crotalaria retusa L. Seeds. American Journal of Plant Sciences 09(01): 46–59.
Deberdt, P.; R. Coranson-Beaudu; P. Fernandes; E. Gozé; P. Lucas; B. Perrin & A. Ratnadass. (2014). Crotalaria spectabilis and Raphanus sativus as previous crops show promise for the control of bacterial wilt of tomato without reducing bacterial populations. Journal of Phytopathology 163(5): 377–385.
Delgado-Oramas, B.P.; M.I. González; H.M.G. Rodríguez & P.O. Pino. (2020). La resistencia inducida por productos derivados de plantas: alternativa para el manejo de plagas agrícolas. Revista de Protección Vegetal, 35(3); 1–12.
Delgadillo-López, A.E.; O. Acevedo-Sandova; C.A. González-Ramírez; F. Prieto-García & J.R. Villagómez-Ibarra. (2011). Phytoremediation: An alternative to eliminate pollution. Tropical and Subtropical Agroecosystems 14(2): 597–612.
Devendra, B.N.; K. S. Solmon & N. Srinivas. (2012). A comparative pharmacological and phytochemical analysis of in vivo & in vitro propagated Crotalaria species. Asian Pacific Journal of Tropical Medicine 5(1): 37–41.
Dhole, J. A.; S.S. Bodke; N.A. Dhole & K.D. Lone. (2011). Journal of Research in Biology Preliminary Phytochemical Analysis and Antimicrobial Activity of Some Weeds collected from Marathwada Region. Journal of Research in Biology 1(2): 19–23.
Diaz, G.J.; L.X. Almeida & D.R. Gardner. (2014). Effects of dietary Crotalaria pallida seeds on the health and performance of laying hens and evaluation of residues in eggs. Research in Veterinary Science 97(2): 297–303.
Dinakaran, S.K.; D. Banji; P. Godala & A. Harani. (2011). Pharmacognostical Evaluation Study on Crotalaria juncea Linn. American-Eurasian Journal of Scientific Research 6(3): 139–145.
Fan, C.M.; G.X. Chou & E.Y. Zhu. (2016). Chemical constituents from Crotalaria sessiliflora L. Acta Pharmaceutica Sinica 51(5): 775–779.
Fletcher, M.T.; B.J. Blaney; R.A. McKenzie & K.G. Reichmann. (2009). Pyrrolizidine alkaloids in Crotalaria taxa from Northern Australia: Risk to grazing livestock. Journal of Agricultural and Food Chemistry 57(1): 311–319.
Gamage, W.; T.M. Brown; W. Gamage & K. Masakorala. (2020). Tolerance of Impatiens balsamina L., and Crotalaria retusa L. to grow on soil contaminated by used lubricating oil: A comparative study. Ecotoxicology and Environmental Safety 188: 109911.
Garduza, A.B.; M.C.C. Bautista; de los S.G. García; F.A. Hernández; E.L.C. Lagunes & C.J.M. Zaldívar. (2020). Germination of Crotalaria and Lupinus (Fabaceae) seeds submitted to different pre-germination treatments and their effect on enzymatic activity during early germination. Brazilian Journal of Biology 80(1): 23–29.
Geilfus, C.M. (2019). Plant Secondary Compounds. En Controlled Environment Horticulture. Springer, Cham. pp. 19–33.
Gomes, C.E.M.; L.B.S. Andrade; A.E.A.D. Barbosa; F.P. Macedo; L.L.P. Macedo; F.T. Moura; R.M. Moura; A.S. Oliveira; J.C.M. Pitanga; A.F.S. Queiroz; M.P. Sales & M.S. Vidal. (2005). Effect of trypsin inhibitor from Crotalaria pallida seeds on Callosobruchus maculatus (cowpea weevil) and Ceratitis capitata (fruit fly). Plant Physiology and Biochemistry 43(12): 1095–1102.
Govindappa, M.; N. Bharath; T.S. Sadananda; P. Sharanappa & H.B. Shruthi. (2011). Antimicrobial, antioxidant and in vitro anti-inflammatory activity and phytochemical screening of Crotalaria pallida Aiton. African Journal of Pharmacy and Pharmacology 5(21): 2359–2371.
Guerra-Centeno, D.; M. Díaz; H. Fuentes-Rousselin; L. Ríos; M. Rodenas; J.C. Valdez-Sandoval & F. Villatoro. (2016). Crecimiento de la cría de tilapia nilótica (Oreochromis niloticus) utilizando hojas de chipilín (Crotalaria longirostrata) como sustituto parcial del alimento balanceado. Revista Electrónica de Veterinaria 17(10): 1–12.
Hou, B.; S. Feng & Y. Wu. (2017). Systemic Identification of Hevea brasiliensis EST-SSR Markers and Primer Screening. Journal of Nucleic Acids 2017(6590902): 1–9.
Hu, X.R.; G.X. Chou & C.G. Zhang. (2017). Flavonoids, alkaloids from the seeds of Crotalaria pallida and their cytotoxicity and anti-inflammatory activities. Phytochemistry 143: 64–71.
Jiménez, A.D.M. & M.A. Grusak. (2015). Evaluation of Minerals, Phytochemical Compounds and Antioxidant Activity of Mexican, Central American, and African Green Leafy Vegetables. Plant Foods for Human Nutrition 70(4): 357–364.
Kamath, S.; R. Mundugaru; B. Ravishankar & M. Sharma. (2017). In-vivo study of tissue reaction to Crotalaria pallida and Sansevieria roxburghiana fibers. Journal of Ayurveda and Integrative Medicine 8(2): 82–87.
Kar, S. & B.K. Datta. (2018). Reproductive biology of Crotalaria spectabilis Roth. The International Journal of Plant Reproductive Biology 10(1): 38–43.
Kay, J. M. (2017). Crotalaria (Monocrotaline) Pulmonary Hypertension: The Fiftieth Anniversary. Chest, 152(6): 1117–1119.
Le Roux, M.M.; J.S. Boatwright; A.N. Moteetee; P.M. Tilney & B.E. Van Wyk. (2010). The taxonomic value of fruit wall structure in the genus Crotalaria (Fabaceae, tribe Crotalarieae). South African Journal of Botany 76(2): 397.
Le Roux, M.M. & B.E. Van Wyk. (2012). The systematic value of flower structure in Crotalaria and related genera of the tribe Crotalarieae (Fabaceae). Flora: Morphology, Distribution, Functional Ecology of Plants 207(6): 414–426.
López-López, H.; M. Beltrán-Beache; Y.M. Ochoa-Fuentes; E. Castro-Del Ángel; E. Cerna-Chávez & J.C. Delgado-Ortiz. (2022). Extracto metanólico de Crotalaria longirostrata: Identificación de metabolitos secundarios y su efecto insecticida. Scientia Agropecuaria 13(1): 71-78.
Lynch, M.J.; S.C. Hodges; M.J. Mulvaney; T.L. Thompson & W.E. Thomason. (2016). Decomposition, nitrogen and carbon mineralization from food and cover crop residues in the central plateau of Haiti. SpringerPlus 5(973): 1–9.
Mateos-Maces L.; J.J.E. Alba; B.E.N. Aquino; S.J.L. Chávez; G.A.M. Vera & G.B.B. Villagómez. (2020). Edible Leafy Plants from Mexico as Sources of Antioxidant Compounds, and Their Nutritional, Nutraceutical and Antimicrobial Potential: A Review. Antioxidants 9(541): 1–24.
Miranda-Granados, J.; G.P. Álvarez; C. Chacón; R.S. Lagunas; G.R. Meza; L.N. Ruiz; D.E.Vargas & L.G. Zepeda. (2018). Alternative Use of Extracts of Chipilín Leaves (Crotalaria longirostrata Hook. & Arn) as Antimicrobial. Sustainability 10 (3): 883.
Mondin, M. & M.L.R. Aguiar-Perecin. (2011). Heterochromatin patterns and ribosomal DNA loci distribution in diploid and polyploid Crotalaria species (Leguminosae, Papilionoideae), and inferences on karyotype evolution. Genome 54(9): 718–726.
Monquero, P.; L. Barbosa; M. Côrrea; A. Gutierrez; A.C. Hirata & I. Orzari. (2013). Selection of Green Manure Species aiming at Diclosulam Phytoremediation. Planta Daninha 31(1): 127–135.
Mosjidis, J.A. & M.L. Wang. (2011). Crotalaria. En K.C. (Ed.), Wild Crop Relatives: Genomic and Breeding Resources. Springer, Berlín, Heidelberg. pp. 63–69.
Muli, K.J.; N.L.M. Budambula; K.P. Kamau; O.J. Neondo & E. Odari. (2021). Phenomic characterization of Crotalaria germplasm for crop improvement. CABI Agriculture and Bioscience 2(1): 1–15.
Navarro-Flores, M.J.; A.M. Abud; T.T. del R. Ayora; G.R. Meza & C.L.M.C. Ventura. (2020). Spray drying encapsulation of a native plant extract rich in phenolic compounds with combinations of maltodextrin and non-conventional wall materials. Journal of Food Science and Technology 57(11): 4111–4122.
Ogunsusi, M.; A.O. Akinlalu; I.J. Komolafe & O.O. Oyedapo. (2018). Allelopathic effects of alkaloid fraction of Crotalaria retusa Linn on growth and some biochemical parameters of bean seedlings (Phaseolus vulgaris). International Journal of Plant Physiology and Biochemistry 10(1): 1–9.
Oliveira, de D.P.; E.S.B. Cavalcanti; M.L. Furtado; R.A. Montes; S.M. de Morais; C.C.C. Pinto; L.M.B. dos Santos & E.S. da Silva. (2020). Phytochemical profile and antioxidant potential of Ethanol extracts of the species Bauhinia monandra Kurz (Fabaceae). Brazilian Journal of Development 6(11): 86551–86564.
Oliveira, P.R.; B.C. Almeida; E.S. Alvarenga; A.J. Demuner & S.T. de Melo. (2018). A novel alkaloid isolated from Crotalaria paulina and identified by NMR and DFT calculations. Journal of Molecular Structure 1152: 337–343.
Pandey, A.; D.C. Bhandari; R. Singh & S.K. Sharma. (2010). Diversity assessment of useful Crotalaria species in India for plant genetic resources management. Genetic Resources and Crop Evolution 57(3): 461–470.
Peñaloza, A.G.C. & J.C.A. Pelaez. (2008). Evaluación de la actividad biológica Crotalaria juncea mediante el modelo Drosophila melanogaster. Revista de la Facultad de Química Farmacéutica 15(2): 279–284.
Peñaloza, A.G.C. & J.C.A. Peláez. (2014). Evaluación de la actividad biológica de extractos de semillas de Crotalaria pallida (cascabelito) sobre el modelo Drosophila melanogaster. Revista Cubana de Plantas Medicinales 19(3): 144–153.
Peñaloza, A.G.C. & J.C.A. Peláez. (2017). Aislamiento del estigmasterol de las semillas de Crotalaria juncea L. (cascabelito) y su bioactividad sobre Drosophila melanogaster. Revista Cubana de Plantas Medicinales 22(3): 1-7.
Prada, F.; J.R. Martínez & E.E. Stashenko. (2020). LC/MS study of the diversity and distribution of pyrrolizidine alkaloids in Crotalaria species growing in Colombia. Journal of Separation Science 43(23): 4322–4337.
Prasad, J.; K.R. Arya; S.K. Awasthi; G. Bhatia; U. Chaturvedi; T. Narender; V.K. Singh & A. Shrivastava. (2013). Antidyslipidemic and antioxidant activity of an unusual amino acid (2-amino-5-hydroxyhexanoic acid) isolated from the seeds of Crotalaria juncea. Phytomedicine 21(1): 15–19.
Raj, J.M.L.; J.S. Britto; S. Prabhu & S.R. Senthilkumar. (2011). Phylogenetic relationships of Crotalaria species based on seed protein polymorphism revealed by SDS-PAGE. International Research Journal of Plant Science 2(5): 119–128.
Rakesh, S.R.; M.N. Ganesan; M. Kumar & M.R. Srinivasan. (2019). Studies on diversity, abundance and pollination efficiency of insect pollinators and pollination mechanism involved in sunnhemp (Crotalaria juncea L.). Electronic Journal of Plant Breeding 10(2): 838–851.
Rodríguez, M.G.; L. Gómez & B. Peteira. (2007). Meloidogyne mayaguensis RAMMAH Y HIRSCHMANN, plaga emergente para la agricultura tropical y subtropical. Revista de Protección Vegetal 22(3): 183–198.
Rojas-Sandoval, J. (2016). Crotalaria spectabilis (vidente cascabel). Invasive Species Compendium. Wallingford, UK: CABI. Disponible en: https://www.cabi.org/isc/datasheet/16161. Ultimo acceso: agosto de 2021.
Rovira, D.; C. Alfaro; V. Martínez & I. Menjívar. (2019). Respiration rate and shelf-life study of Crotalaria longirostrata (chipilín). Journal of Food Measurement and Characterization 13(4): 3025–3032.
Saboon; N. Ahmad; M. Arshad; Y. Bibi; S.K. Chaudhari & I. Riaz. (2015). An insight into medicinal and ethnopharmacological potential of Crotalaria burhia. Asian Pacific Journal of Tropical Disease 5(7): 511–514.
Salinas-Morales, J.L.; C.B. Peña-Valdivia; C. Trejo; M. Vázquez-Sánchez; C. López-Palacios & D. Padilla-Chacón. (2022). Componentes del rendimiento de Crotalaria longirostrata Hook. & Arn. en Guerrero, México. Polibotánica 54: 101–121.
Satya, P.; R. Banerjee; A. Bera; B. Chaudhary; M. Karan; R.T. Maruthi; E. Mukhopadhyay & S.K. Sarkar. (2016). Insight into genetic relation and diversity of cultivated and semi-domesticated under-utilized Crotalaria species gained using start codon targeted (SCoT) markers. Biochemical Systematics and Ecology 66: 24–32.
Schinzoumka, P.; A.N. Jean & T. Valère. (2016). Effects of Acacia albida and Crotalaria retusa on the Growth and Development of Tomato. Journal of Agriculture and Ecology Research International 8(3): 1–9.
Scupinari, T.; C.B. Hoffmann-Campo; R.H. Mannochio; N.E. de Oliveira; D.W. Pereira; F.A.B. Sabino; B.V. Da Silva & M.L. Zeraik. (2020). Crotalaria spectabilis as a source of pyrrolizidine alkaloids and phenolic compounds: HPLC-MS/MS dereplication and monocrotaline quantification of seed and leaf extracts. Phytochemical Analysis 31(6): 747–755.
Sinan, K.I.; O.K. Etienne; M.F. Mahomoodally; S.K. Pavelić; Ž. Peršurić; M.C.N. Picot-Allain; L. Saftić & G. Zengin. (2020). A comparative study of the chemical composition, biological and multivariate analysis of Crotalaria retusa L. stem barks, fruits, and flowers obtained via different extraction protocols. South African Journal of Botany 128: 101–108.
Singtonat, S. & M. Osathanunkul. (2015). Fast and reliable detection of toxic Crotalaria spectabilis Roth. in Thunbergia laurifolia Lindl. herbal products using DNA barcoding coupled with HRM analysis. BMC Complementary and Alternative Medicine 15(1): 1–8.
Skinner, E.M.; J.C. Díaz-Pérez; S.C. Phatak; H.H. Schomberg & W. Vencill. (2012). Allelopathic effects of sunnhemp (Crotalaria juncea L.) on germination of vegetables and weeds. HortScience 47(1): 138–142.
Stegelmeier, B.L. (2011). Pyrrolizidine Alkaloid-Containing Toxic Plants (Senecio, Crotalaria, Cynoglossum, Amsinckia, Heliotropium, and Echium spp.). Veterinary Clinics of North America - Food Animal Practice 27(2): 419–428.
Subaedah, S.; A. Aladin & Nirwana. (2016). Fertilization of Nitrogen, Phosphor and Application of Green Manure of Crotalaria juncea in Increasing Yield of Maize in Marginal Dry Land. Agriculture and Agricultural Science Procedia 9: 20–25.
Subramaniam, S.; R. Geeta; M.E. Mort & A.K. Pandey. (2013). Molecular systematics of Indian Crotalaria (Fabaceae) based on analyses of nuclear ribosomal ITS DNA sequences. Plant Systematics and Evolution 299(6); 1089–1106.
Sut, S.; K. Bene; S. Dall’Acqua; G. Kumar; M.F. Mahomoodally; C. Picot-Allain; K.I. Sinan & G. Zengin. (2020). Cola caricifolia (G.Don) K. Schum and Crotalaria retusa L. from Ivory Coast as sources of bioactive constituents. Industrial Crops and Products 147: 112246.
Sutjaritjai, N.; H. Balslev; A. Inta & P. Wangpakapattanawong. (2019). Traditional uses of leguminosae among the Karen in Thailand. Plants 8(12): 1-20.
Suwanchaikasem, P.; T. Phadungcharoen & S. Sukrong. (2013). Authentication of the Thai medicinal plants sharing the same common name “Rang Chuet”: Thunbergia laurifolia, Crotalaria spectabilis, and Curcuma aff. amada by combined techniques of TLC, PCR-RFLP fingerprints, and antioxidant activities. ScienceAsia 39(2): 124–133.
Thomas, B.; I. Balachandran; S. George; K.M.P. Kumar & A. Rajendran. (2012). A new variety of Crotalaria ramosissima (Fabaceae) from Tamil Nadu, India. Asian Pacific Journal of Tropical Biomedicine 2(3 SUPPL.): S1412–S1414.
Tripathi, M.K.; H.R. Bhandari; B. Chaudhary & S.R. Singh. (2013). Growth and yield of sunnhemp (Crotalaria juncea L.) as influenced by spacing and topping practices. African Journal of Agricultural Research 8(28): 3744–3749.
Ukil, S.; S. Laskar & R. N. Roy. (2016). Physicochemical characterization and antibacterial activity of the leaf oil of Crotalaria pallida Aiton. Journal of Taibah University for Science 10(4). 490–496.
Vergun, O.; J. Brindza; O. Grygorieva; E. Ivanišová; D. Rakhmetov & O. Shymanska. (2020). Parameters of antioxidant activity of Galega officinalis L. and Galega orientalis Lam. (fabaceae Lindl.) plant raw material. Potravinarstvo Slovak Journal of Food Sciences 14: 125–134.
Villalobos, S. & N. Ramírez. (2010). Biología reproductiva de Crotalaria micans Link (Fabaceae): Especie colonizadora de amplia distribución geográfica. Acta Botánica Venezuelica 33(1): 67–81.
Wanapat, M.; M. Matra; P. Totakul & B. Viennasay. (2021). Sunnhemp (Crotalaria juncea, L.) silage can enrich rumen fermentation process, microbial protein synthesis, and nitrogen utilization efficiency in beef cattle crossbreds. Tropical Animal Health and Production 53(187): 1-7.
Wang, M.L.; R.E. Dean; T.M. Jenkins; J.A. Mosjidis; J.B. Morris & G.A. Pederson. (2006). Genetic diversity of Crotalaria germplasm assessed through phylogenetic analysis of EST-SSR markers. Genome 49(6): 707–715.
Yashim, S.M.; D.O. Anene & I.U. Gadzama. (2017). Effect of sampling time on Haematological Characteristics of Weaner rabbits fed diets containing differently processed Crotalaria retusa Leaves. Nigerian Journal of Animal Science 19(1): 192–202.
Yoo, S.H.; J. Kim; Y.C. Kim & S.J. Lee. (2004). Flavonoids of Crotalaria sessiliflora. Archives of Pharmacal Research 27(5): 544–546.
Zhang, W.; H. Fan; W. Huai; J. Shen; X. Tang; K. Wang; X. Xie & Y. Zhang (2017). Ultra-Performance Liquid Chromatography Hyphenated with Quadrupole-Orbitrap Mass Spectrometry for Simultaneous Determination of Necine-Core-Structure Pyrrolizidine Alkaloids in Crotalaria sessiliflora L. without all Corresponding Standards. Phytochemical Analysis 28(5): 365–373.
Notas de autor
jdelgado@conacyt.mx; moe_788@hotmail.com

