Efecto inhibitorio in vitro de extractos de ricino (Ricinus communis) sobre el crecimiento de Alternaria tenuissima
In vitro inhibitory effect of castor bean (Ricinus communis) leaf extracts on the growth of Alternaria tenuissima
Revista de la Facultad de Agronomía
Universidad Nacional de La Plata, Argentina
ISSN: 1669-9513
Periodicidad: Semestral
vol. 121, núm. 2, 2022
Recepción: 21 Julio 2022
Aprobación: 07 Septiembre 2022
Autor de correspondencia: eugesuarez78@gmail.com
Resumen: El objetivo de este estudio fue evaluar el potencial inhibitorio de extractos acuosos y etanólicos de hojas de Ricinus communis sobre el crecimiento de una cepa de Alternaria tenuissima, especie fitopatógena que afecta a gran variedad de cultivos ornamentales y alimenticios. Este trabajo derivó de una investigación etnobotánica sobre plantas tóxicas del partido de Vicente López (Buenos Aires, Argentina), en el que el ricino, planta invasora y exótica, sobresalió como una de las especies más conocidas de la zona y de mayor consenso en cuanto a su potencial tóxico. Los extractos se obtuvieron mediante maceración de las hojas de .. communis durante 24 h en los siguientes solventes: agua destilada, etanol al 25% y etanol al 50%. El efecto inhibitorio de los distintos extractos contra .. tenuissima se evaluó utilizando la técnica del medio de cultivo envenenado a cuatro concentraciones: 25, 12, 6 y 3%. A los 8 días de cultivo se registró el crecimiento miceliar (áreas colonizadas) para cada tratamiento. Los extractos acuosos de las hojas de .. communis presentaron efecto inhibitorio sobre el crecimiento de la cepa evaluada, con un máximo del 55%. El etanol, tanto al 25% como al 50%, tuvo un efecto completamente inhibitorio y por tanto no fue posible evaluar el efecto de los extractos etanólicos de ricino. Los resultados indican que tanto las mezclas etanol-agua como los extractos acuosos de hojas de ricino son alternativas prometedoras para la protección vegetal, evaluando previamente sus parámetros ecotoxicológicos.
Palabras clave: fitopatógenos, alternariosis, efecto antifúngico, fitosanidad, plantas tóxicas.
Abstract: The purpose of this study was to evaluate the inhibitory potential of aqueous and ethanolic extracts from leaves of Ricinus communis against a strain of Alternaria tenuissima, a phytopathogenic species that affects a great variety of ornamental and food crops. This work arose from an ethnobotanical research on toxic plants carried out in Vicente López district (Buenos Aires, Argentina), in which R. communis, an exotic and invasive plant, appeared as one of the most known species and with major consensus regarding its toxic potential. The extracts were obtained by maceration of the leaves for 24 h in the following solvents: distilled water, 25% ethanol and 50% ethanol. The inhibitory effect of the different extracts against .. tenuissima was evaluated using the poisoned medium technique at four concentrations: 25, 12, 6 and 3%. After 8 days of culture, micellar growth (colonized areas) was registered for each treatment. The aqueous extracts from leaves of .. communis showed an inhibitory effect against the growth of the evaluated strain, with a maximum of 55%. Ethanol, at both 25% and 50%, had a total inhibitory effect, thus it was not possible to evaluate the effect of the ethanolic extracts. Results suggest that the mixtures ethanol-water as well as the aqueous extracts from leaves of .. communis are promising alternatives for plant protection, with a previous ecotoxicological parameters.
Keywords: phytopathogens, alternariosis, antifungal effect, plant health, toxic plants.
Alternaria Nees (Ascomycota, Pleosporaceae) es un género fúngico ubicuo que incluye especies saprófitas, endófitas y patógenas (Woudenberg et al., 2013). Las especies fitopatógenas de este género afectan a una amplia variedad de cultivos ornamentales, hortícolas y frutales, y producen daños sobre órganos almacenados (Logrieco et al., 2009). En particular, la especie A. tenuissima ocasiona importantes pérdidas económicas en cultivos; por ejemplo, genera manchas foliares en amaranto (Amaranthus hybridus L.) y remolacha (Beta vulgaris L.), y causa pudrición de inflorescencias en brócoli (Brassica oleracea L.) (Blodgett & Swart, 2002; Fraire-Cordero et al., 2010; Khan et al., 2020). En postcosecha, es capaz de generar podredumbre seca del interior de la manzana [Malus x domestica (Borkh.)] y pudrición del tubérculo de papa (Solanum tuberosum L.) (Kou et al., 2014; Liu et al., 2019), entre otros.
En agricultura convencional, la práctica más frecuente para controlar patógenos es la aplicación de fungicidas sintéticos. Sin embargo, es cada vez mayor la conciencia global sobre la necesidad de alternativas para un manejo fitosanitario de menor impacto ambiental, por los consabidos problemas que los agroquímicos ocasionan en la salud ambiental y humana (Sarandón & Flores, 2014; Zacker, 2016). En esta línea, algunos de los fungicidas recomendados para combatir alternariosis, como el mancozeb (ditiocarbamato) y el iprodione (dicarboximida), están siendo objeto de reevaluaciones de toxicidad debido a la creciente evidencia de su potencial como cancerígenos para los seres humanos. De hecho, recientemente la Unión Europea ha suspendido el uso del mancozeb y ha disminuido el límite máximo de residuos de iprodione permitido en los alimentos (EFSA, 2016; Cocco, 2022). Adicionalmente, el uso recurrente de estos compuestos ha derivado en el origen de cepas fitopatógenas resistentes (Tripathi & Dubey, 2004). Por lo expuesto, la posibilidad de recurrir a antifúngicos distintos a los convencionales resulta una alternativa interesante. Actualmente, los productos a base de extractos vegetales son una de las opciones más prometedoras que están siendo exploradas, ya que las plantas producen una amplia variedad de metabolitos secundarios que actúan como una defensa contra patógenos y herbívoros (Wittstock & Gershenzon, 2002). Además, la mayoría de estos compuestos no sólo son biodegradables y suelen ser de baja o nula toxicidad para mamíferos, sino que presentan una escasa probabilidad de desarrollar resistencia por parte de los organismos patógenos, debido a que no son específicos en su modo de acción (Tripathi & Dubey, 2004; Zacker, 2016).
El ricino (Ricinus communis L., Euphorbiaceae) es una planta arbórea, arbustiva o subarbustiva anual en zonas templadas y perenne en zonas tropicales y subtropicales, nativa del noreste de África, que ha sido introducida en gran parte del mundo y registrada como invasora, tanto en áreas silvestres como en cultivos. Sus hojas, largamente pecioladas, son suborbiculares con lóbulos acuminados. Florece en verano y fructifica en otoño (Dimitri, 1972; Subramaniyan, 2020). Se conocen diversos usos medicinales para el ricino desde tiempos antiguos. Su aceite, conocido como aceite de castor, se obtiene de las semillas y tiene una gran importancia terapéutica desde tiempos antiguos (Marwat et al., 2017; Subramaniyan, 2020). Sin embargo, las semillas de esta especie concentran una glicoproteína soluble en agua denominada ricina que es capaz de originar serias intoxicaciones por ingesta en los humanos y otros animales (Audi et al. 2005; Worbs et al., 2011; Moshiri et al., 2016), por lo que el uso de extractos de semillas para diversos fines debe manejarse con suma cautela. Las hojas también son empleadas en medicina popular en diversas preparaciones: infusiones para tratar dolores de estómago, aceite para calmar flatulencia en niños, o cataplasmas para curar llagas, forúnculos o hinchazones (Kumar, 2017; Elkousky et al., 2021). Estudios fitofarmacológicos revelaron la presencia de alcaloides (ricinina y N-dimetil-ricinina), monoterpenoides (β-thujona, 1,8-cineol, alcanfor, α-pineno), ácidos fenólicos (ácido gálico) y flavonoides (quercetina, kaempferol y sus glicoderivados) en las hojas de esta especie, todos metabolitos secundarios con potencial antimicrobiano (Kang et al., 1985; Jena & Gupta 2012; Ribeiro et al., 2016). Además, existen antecedente del efecto inhibitorio de extractos acuosos y etanólicos de hojas de ricino en el crecimiento de distintas especies de hongos fitopatógenos de los géneros Aspergillus, Candida y Fusarium (Siva et al., 2008; Jena & Gupta, 2012; Naz & Bano, 2012). Particularmente, Bayaso et al. (2013) y Kalpashree y Raveesha (2016) han observado reducciones significativas en el crecimiento de Alternaria solani (Ellis & G. Martin) L.R. Jones & Grout con extractos acuosos de la hoja de esta especie.
Este trabajo surge de una investigación sobre plantas tóxicas del partido de Vicente López (Argentina) enmarcada en la etnobotánica (Valerio et al., 2022). En dicho estudio, el ricino sobresalió como una de las especies más conocidas de la zona y de mayor consenso en cuanto a su potencial tóxico. Este hecho, sumado a los antecedentes referidos y a la abundancia de la especie en Vicente López debido a su carácter invasor, llevó a la realización del presente trabajo como parte de la instancia de “devolución a la sociedad”, común en las investigaciones etnobotánicas. En este sentido, se realizó un estudio del efecto de extractos de hojas de ricino sobre A. tennuisima, que es un fitopatógeno común en jardines y huertos, a fin de aportar a la identificación de especies de plantas que permitan la elaboración de preparados artesanales para combatirla. Así, el objetivo de este trabajo fue evaluar el potencial inhibitorio de extractos acuosos y etanólicos de hojas de R. communis sobre el crecimiento de A. tenuissima.
Para llevar a cabo el ensayo, se emplearon hojas de ricino recolectadas de 3 ejemplares adultos localizados en zonas aledañas al Río de la Plata en la localidad de Vicente López (partido de Vicente López, Buenos Aires, Argentina). Las hojas se desinfectaron por medio del lavado con hipoclorito de sodio 2,5 g/l durante 5 min y se secaron a temperatura ambiente. Luego, fueron trituradas y tamizadas con una malla de 1 mm para descartar las partículas más finas. Posteriormente, el material se secó a 70°C hasta alcanzar un peso constante. Se tomaron fracciones de 15 g de material que se maceraron durante 24 h en: a) 100 ml de agua destilada estéril, b) 100 ml de etanol al 25%, c) 100 ml de etanol al 50%. Los extractos obtenidos se filtraron al vacío utilizando un filtro de celulosa Whatman N°1 y centrifugaron durante 10 minutos a 3.500 rpm (Roleo mod. 2036). El sobrenadante colectado (solución madre) se esterilizó utilizando filtros de inyección descartables de 0,2 µm (Sartorius).
En relación al patógeno vegetal, se utilizó una cepa fitopatógena de Alternaria tenuissima (INTA IF-531) aislada de manchas foliares de calibrachoa INTA 06575 (Calibrachoa hybrida Llave & Lex., Solanaceae), depositada en el cepario del Laboratorio de Sanidad del Instituto de Floricultura del Instituto Nacional de Tecnología Agropecuaria (Borrelli et al., 2018). El mantenimiento de la cepa se realizó en medio de cultivo extracto de malta 12,7%, glucosa 10% y agar 20% (MEA), a 4ºC.
Se evaluó la actividad antifúngica de los distintos extractos sobre A. tenuissima con la técnica del medio de cultivo envenenado (Balouiri et al., 2016). Para esto, se cultivó A. tenuissima en placas de Petri de 90 mm con 20 ml de MEA y 5 ml de los extractos al 100, 50, 25 y 12,5% (v/v). De esta forma, las concentraciones finales evaluadas para cada extracto fueron del 25, 12, 6 y 3%. Los controles negativos (0% de extracto) se realizaron reemplazando el volumen de cada extracto por los respectivos solventes de extracción. Como control positivo, se realizaron cultivos en MEA con el fungicida Rovral (iprodione 50% m/m) en una concentración final de principio activo de 0,05% m/v, en coincidencia con la concentración sugerida por el fabricante para su empleo en cultivo. Los medios envenenados fueron inoculados con discos de 4 mm de diámetro de cultivos de A. tenuissima en fase de crecimiento exponencial en MEA y se incubaron a 28ºC en condiciones de oscuridad. Se cuantificó el efecto antifúngico de los extractos en sus diferentes concentraciones como la diferencia entre las áreas colonizadas por A. tenuissima en el medio envenenado en relación a los controles negativos, al momento en el que en estos últimos las colonias del hongo alcanzaron el margen de las placas (8 días). El área de crecimiento se calculó analizando fotografías con el software ImageJ (US National Institutes of Health) (Schneider et al., 2012). Todos los ensayos se realizaron por triplicado.
El análisis estadístico de los tratamientos se realizó mediante ANOVA de un factor, previa comprobación de los supuestos de normalidad y homocedasticidad. El contraste de los tratamientos se efectuó a posteriori mediante test de Tukey. En ambos casos, el valor de significancia seleccionado fue de 0.05. Se utilizó el software R v.3.6.1. (R Core Team, 2019).
Todos los tratamientos con etanol inhibieron por completo el crecimiento de A. tenuissima, incluyendo a los controles negativos (Tabla 1). Debido a esto, no fue posible evaluar el efecto de los extractos obtenidos sobre el crecimiento fúngico de esta especie. Por su parte, el área de crecimiento registrada en el tratamiento con iprodione 0,05% m/v fue de 1,9 (±1,9) (Tabla 1 y Figura 1).
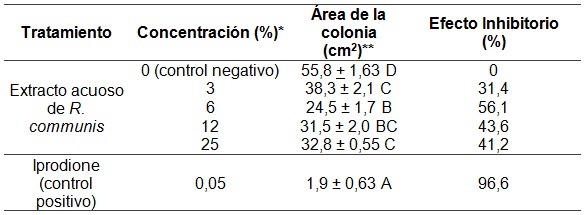
Tabla 1
Efecto sobre A. tenuissima del extracto acuoso de hojas de R. communis. % v/v (respecto del extracto concentrado). % m/v para el iprodione. **Los valores corresponden a la media de 3 réplicas ± error estándar. Letras diferentes denotan diferencias significativas (p<0,05) mediante Test de Tukey.
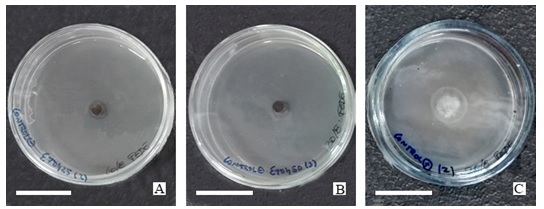
Figura 1
Cultivos de A. tenuissima a 8 días de la siembra en MEA suplementados con: A) etanol 25% (control negativo) ; B) etanol 50% (control negativo); C) iprodione 0,05% m/v (control positivo).
El análisis estadístico de los extractos acuosos de ricino evidenció un efecto de la variable concentración de extracto sobre el crecimiento fúngico (p<0.001) (ver Tabla 1 y Figura 2). Se observa una disminución significativa en el área colonizada por A. tenuissima en las distintas concentraciones de extracto con respecto al control negativo acuoso (test de Tukey, p<0.05) (Tabla 1). A su vez, el área colonizada en los medios con extracto al 6% difiere significativamente de aquellos con extracto al 3% y al 25% (p<0,05), pero no al 12%. Los medios con extracto al 12%, con un área colonizada similar a la del extracto al 25%, no presentaron diferencias con los demás tratamientos acuosos, a excepción del control negativo. Todos los tratamientos mencionados difirieron respecto al control positivo (ver Tabla 1).
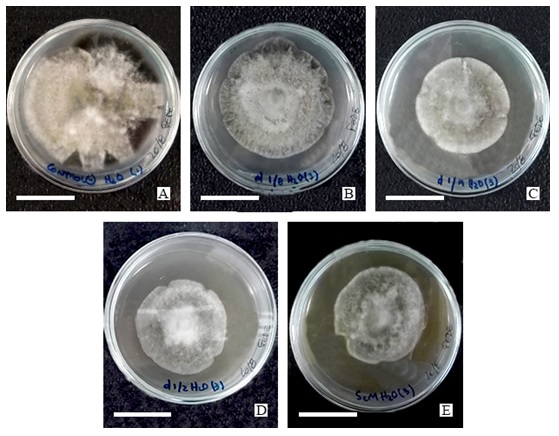
Figura 2
Crecimiento de A. tenuissima a los 8 días desde la siembra en MEA en los distintos tratamientos acuosos: A) control negativo acuoso (0% extracto de ricino); B) 3% extracto de ricino; C) 6% extracto de ricino; D) 12% extracto de ricino; E) 25% extracto de ricino.
Los resultados obtenidos indican que las mezclas de etanol en agua al 25% y al 50% inhiben completamente el crecimiento de A. tenuissima. Por este motivo, no se pudo distinguir, y por lo tanto evaluar, los efectos de los extractos alcohólicos de hojas de ricino en dichos solventes. Al respecto, algunos autores han destacado que el efecto inhibitorio que es capaz de ocasionar el etanol sobre las células de los hongos se debe principalmente a su acción sobre la membrana plasmática, al modificar su estructura y de esta forma influir directamente sobre la asimilación de agua y nutrientes (Thomas & Rose, 1979; Dao & Dantigny, 2011). Sin embargo, las concentraciones mínimas inhibitorias del crecimiento varían de forma considerable entre distintas especies o cepas fúngicas (Dantigny et al., 2005). Para la cepa de A. tenuissima evaluada en este trabajo, el etanol en agua logró inhibir el crecimiento in vitro tanto o más que el iprodione, por lo que podría resultar una alternativa interesante a los fungicidas convencionales para el tratamiento de las enfermedades que causa este hongo en cultivos y frutos almacenados (USDA National Organic Program, 2001; Dao & Dantigny, 2011). Aun así, es necesario profundizar y ampliar los ensayos in vitro al respecto, por ejemplo, evaluando otras cepas y especies de Alternaria y analizando alteraciones morfológicas y de producción de conidios, así como evaluar la factibilidad del uso de etanol en los cultivos. Autores como Rowe et al. (1994) y Rajala et al. (1998) han ensayado la pulverización foliar en plantas de tomate (Solanum lycopersicum L.) hasta concentraciones de etanol del 20% (v/v), y en avena (Avena sativa L.) y nabo (Brassica rapa L.) hasta concentraciones del 40% (v/v), sin observar fitotoxicidad. Para avanzar sobre esta posibilidad, sería oportuno realizar estudios in vitro con otras cepas de A. tenuissima para determinar, por ejemplo, si el efecto de las mezclas etanol-agua no se debe a una hipersensibilidad de la cepa testeada; asimismo, sería conveniente ensayar concentraciones de etanol inferiores al 25%, a fin de determinar la mínima concentración inhibitoria del crecimiento, así como replicar el ensayo en condiciones in vivo, luego de inoculaciones en plantas.
En los tratamientos realizados con extractos acuosos de hojas de ricino, se observó que el crecimiento del patógeno alcanzó la máxima inhibición (55%) en la dilución al 6%, difiriendo significativamente de las demás concentraciones ensayadas (Tabla 1). Si bien la inhibición disminuyó con el extracto al 25% en relación con el 6%, se requerirían ensayos adicionales para discriminar si lo observado se debe, efectivamente, a un efecto biológico o a una limitante metodológica. Estos resultados son similares a los obtenidos por Bayaso et al. (2013) para Alternaria solani. En ese trabajo, los autores evaluaron el efecto de distintas diluciones obtenidas a partir de un extracto acuoso (40 g/100 ml) de tallo y hojas de R. communis sobre el crecimiento in vitro de A. solani, observando porcentajes de inhibición máximos del orden del 50%. Adicionalmente, Kalpashree y Raveesha (2016), en un estudio sobre el efecto de distintas concentraciones de extractos acuosos de 25 especies vegetales sobre el crecimiento de A. solani, registraron para las hojas de ricino el tercer porcentaje de inhibición más elevado (cercano a 70 %). Por su parte, se ha observado también que los extractos acuosos de hojas de ricino presentan efecto inhibitorio sobre Fusarium oxysporum f. sp. melongenae y F. oxysporum f. sp. cumini (Sharma & Trivedi, 2002; Siva et al., 2008). En esta línea, el presente trabajo amplía el conocimiento sobre el potencial inhibitorio de los extractos acuosos de hojas de ricino sobre el crecimiento de especies fitopatógenas del género Alternaria. Asimismo, incrementa el tipo y número de patógenos controlables con estos extractos.
Varios estudios indican que las hojas de ricino contienen sustancias solubles en agua, como alcaloides (ricinina y N-dimetil-ricinina), ácidos fenólicos (ácido gálico) y flavonoides (quercetina, kaempferol), los cuales presentan acción antifúngica (Calderón-Montano et al., 2011; Ghosh et al., 2013; Ibraheem & Maimako, 2014; Rampadarath et al., 2014; Ribeiro et al., 2016; Li et al., 2017; Nguyen & Bhattacharya, 2022). Esto podría explicar los resultados obtenidos en este trabajo con los extractos acuosos.
Por lo expuesto, y dado que el ricino es una especie de amplia distribución y abundancia en Vicente López, los extractos acuosos de sus hojas son una alternativa fitosanitaria prometedora para el tratamiento de enfermedades fúngicas, que podría ser empleada por los pobladores en sus huertos y jardines. Para esto, es necesario replicar el ensayo en condiciones in vivo, a fin de determinar las concentraciones de extracto efectivas, así como evaluar la potencial toxicidad de los macerados para los usuarios, animales y otros organismos, periodos de degradación y ecotoxicidad, entre otros aspectos.
En este trabajo se observó que los extractos acuosos de las hojas de R. communis presentaron efecto inhibitorio sobre el crecimiento de la cepa de A. tenuissima INTA IF-531. El efecto máximo fue del 55%, lo cual coincide con los hallazgos de un estudio similar llevado a cabo contra otra especie fitopatógena de Alternaria (A. solani). Por su parte, el etanol, tanto al 25 como al 50%, inhibió completamente el crecimiento del hongo, por lo que no fue posible evaluar el efecto de los extractos etanólicos de ricino. Si bien se requieren más ensayos in vitro e in vivo con esta y otras cepas de Alternaria, los resultados de este estudio muestran que tanto las mezclas etanol-agua como los extractos acuosos de hojas de ricino son alternativas prometedoras para la protección vegetal, evaluando previamente sus parámetros ecotoxicológicos.
BIBLIOGRAFÍA
Audi, J.; M. Belson; M. Patel; J. Schier & J. Osterloh. (2005). Ricin poisoning: a comprehensive review. Jama 294(18): 2342-2351. https://doi.org/10.1001/jama.294.18.2342
Balouiri, M.; M. Sadiki & S.K. Ibnsouda. (2016). Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis 6(2): 71-79. https://doi.org/10.1016/j.jpha.2015.11.005
Bayaso, I.; H. Nahunnaro & D.M. Gwary. (2013). Effects of aqueous extract of Ricinus communis on radial growth of Alternaria solani. African Journal of Agricultural Research 8(37): 4541-4545.
Blodgett, J.T. & W.J. Swart. (2002). Infection, colonization, and disease of Amaranthus hybridus leaves by the Alternaria tenuissima group. Plant Disease 86(11): 1199-1205. https://doi.org/10.1094/PDIS.2002.86.11.1199
Borrelli N.P.; S. Stancanelli; J.C. Hagiwara & M.C. Rivera. (2018). Enfermedades foliares en Calibrachoa hybrida (Resumen). Revista Agronómica del Noroeste Argentino 38(1): 61.
Calderón-Montano, J.; E. Burgos-Morón; C. Pérez-Guerrero & M. López-Lázaro. (2011). A review on the dietary flavonoid kaempferol. Mini Reviews in Medicinal Chemistry 11(4): 298-344. https://doi.org/10.2174/138955711795305335
Cocco, P. (2022). Time for re-evaluating the human carcinogenicity of ethylenedithiocarbamate fungicides? A systematic review. International Journal of Environmental Research and Public Health 19(5): 2632. https://doi.org/10.3390/ijerph19052632
Dantigny, P.; A. Guilmart; F. Radoi; M. Bensoussan & M. Zwietering. (2005). Modelling the effect of ethanol on growth rate of food spoilage moulds. International Journal of Food Microbiology 98(3): 261-269. https://doi.org/10.1016/j.ijfoodmicro.2004.07.008
Dao, T. & P. Dantigny. (2011). Control of food spoilage fungi by ethanol. Food Control 22: 360-368. https://doi.org/10.1016/j.foodcont.2010.09.019
Dimitri, M.J. (1972). Enciclopedia argentina de agricultura y jardinería. Acme, Buenos Aires. 1028 pp.
EFSA (European Food Safety Authority). (2016). Peer review of the pesticide risk assessment of the active substance iprodione. EFSA Journal 14(11): 4609. https://doi.org/10.2903/j.efsa.2016.4609
Elkousy, R.H.; Z.N.A. Said; M.A. Abd El-Baseer & S.A. Abu El Wafa. (2021). Antiviral activity of castor oil plant (Ricinus communis) leaf extracts. Journal of Ethnopharmacology 271: 113878. https://doi.org/10.1016/j.jep.2021.113878
Fraire-Cordero, M.D.L.; D. Nieto-Ángel; E. Cárdenas-Soriano; G. Gutiérrez-Alonso; R. Bujanos-Muñiz & H. Vaquera-Huerta. (2010). Alternaria tenuissima, A. alternata y Fusarium oxysporum hongos causantes de la pudrición del florete de brócoli. Revista Mexicana de Fitopatología 28(1): 25-33.
Ghosh, S.; S.S. Tiwari; S. Srivastava; A.K. Sharma, S. Kumar, D.D. Ray & A.K.S. Rawat. (2013). Acaricidal properties of Ricinus communis leaf extracts against organophosphate and pyrethroids resistant Rhipicephalus (Boophilus) microplus. Veterinary Parasitology 192: 259-267. http://dx.doi.org/10.1016/j.vetpar.2012.09.031
Ibraheem, O. & R. Maimako. (2014). Evaluation of alkaloids and cardiac glycosides contents of Ricinus communis Linn. (castor) whole plant parts and determination of their biological properties. International Journal of Toxicological and Pharmacological Research 6(3): 34-42.
Jena, J. & A.K. Gupta. (2012). Ricinus communis Linn: a phytopharmacological review. International Journal of Pharmacy and Pharmaceutical Sciences 4(4): 25-29.
Kalpashree, M.M. & K.A Raveesha. (2016). Efficacy of aqueous plant extracts against Alternaria solani, the causative agent of early blight of tomato. International Journal of Herbal Medicine 4(6): 184-188.
Khan, M.F.R.; M.E. Haque; M. Bloomquist; M.Z.R. Bhuiyan; R. Brueggeman; S. Zhong; S. Poudel; T. Gross; P. Hakk; Y. Leng & Y. Liu. (2020). First report of Alternaria leaf spot caused by Alternaria tenuissima on sugar beet (Beta vulgaris) in Minnesota, USA. Plant Disease 104(2): 580-580. https://doi.org/10.1094/PDIS-03-19-0603-PDN
Kang, S.S.; G.A. Cordell; D.D. Soejarto & H.H.S. Fong. (1985). Alkaloids and flavonoids from Ricinus communis. Journal of Natural Products 48(1): 155-156. https://doi.org/10.1021/np50037a041
Kou, L.P.; V.L. Gaskins; Y.G. Luo & W.M. Jurick. (2014). First report of Alternaria tenuissima causing postharvest decay on apple fruit from cold storage in the United States. Plant Disease 98(5): 690-690. https://doi.org/10.1094/PDIS-07-13-0802-PDN
Kumar, M. (2017). A review on phytochemical constituents and pharmacological activities of Ricinus communis L. Plant. International Journal of Pharmacognosy and Phytochemical Research 9(4): 466-472.
Li, Z.J.; M. Liu; G. Dawuti; Q. Dou; Y. Ma; H.G. Liu & S. Aibai. (2017). Antifungal activity of gallic acid in vitro and in vivo. Phytotherapy research 31(7): 1039-1045. https://doi.org/10.1002/ptr.5823
Liu, J.; X. Zhang; J.F. Kennedy; M. Jiang; Q. Cai & X. Wu. (2019). Chitosan induces resistance to tuber rot in stored potato caused by Alternaria tenuissima. International Journal of Biological Macromolecules 140: 851-857. https://doi.org/10.1016/j.ijbiomac.2019.08.227
Logrieco, A.; A. Moretti & M. Solfrizzo. (2009). Alternaria toxins and plant diseases: an overview of origin, occurrence and risks. World Mycotoxin Journal 2(2): 129-140.
Marwat, S.K.; F. Rehman; E.A. Khan; M.S Baloch; M. Sadiq; I. Ullah; S. Javaria & S. Shaheen. (2017). Review -Ricinus communis- Ethnomedicinal uses and pharmacological activities. Pakistan Journal of Pharmaceutical Sciences 30(5): 1815-1827.
Moshiri, M.; F. Hamid & L. Etemad. (2016). Ricin toxicity: clinical and molecular aspects. Reports of Biochemistry & Molecular Biology 4(2): 60.
Naz, R. & A. Bano. (2012). Antimicrobial potential of Ricinus communis leaf extracts in different solvents against pathogenic bacterial and fungal strains. Asian Pacific Journal of Tropical Biomedicine 2(12): 944-947. https://doi.org/10.1016/S2221-1691(13)60004-0
Nguyen, T.L.A. & D. Bhattacharya. (2022). Antimicrobial activity of quercetin: an approach to its mechanistic principle. Molecules 27(8): 2494. https://doi.org/10.3390/molecules27082494
R Core Team. (2019). R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Rajala, A.; J. Kärkkäinen; J. Peltonen & P. Peltonen-Sainio. (1998). Foliar applications of alcohols failed to enhance growth and yield of C. crops. Industrial Crops and Products .(2-3): 129-137. https://doi.org/10.1016/S0926-6690(97)00041-1
Rampadarath, S.; D. Puchooa & V.M. Ranghoo-Sanmukhiya. (2014). A comparison of polyphenolic content, antioxidant activity and insecticidal properties of Jatropha species and wild Ricinus communis L. found in Mauritius. Asian Pacific journal of tropical medicine 7S1: S384-S390. https://doi.org/10.1016/S1995-7645(14)60263-7
Ribeiro, P.R.; R.D. de Castro & L.G. Fernández. (2016). Chemical constituents of the oilseed crop Ricinus communis and their pharmacological activities: A review. Industrial Crops and Products 91: 358-376. https://doi.org/10.1016/j.indcrop.2016.07.010
Rowe, R.N.; D.J. Farr & B.A.J. Richards. (1994). Effects of foliar and root applications of methanol or ethanol on the growth of tomato plants (Lycopersicon esculentum Mill). New Zealand Journal of Crop and Horticultural Science 22(3): 335-337. https://doi.org/10.1080/01140671.1994.9513842
Sarandón, S.J. & C.C. Flores. (2014). Agroecología: bases teóricas para el diseño y manejo de agroecosistemas sustentables. Editorial de la Universidad Nacional de La Plata (EDULP), La Plata. 466 pp.
Schneider, C.A.; W.S. Rasband & K.W. Eliceiri. (2012). NIH Image to ImageJ: 25 years of image análisis. Nature Methods 9(7): 671-675. https://doi.org/10.1038/nmeth.2089
Sharma, N. & P.C. Trivedi. (2002). Screening of leaf extracts of some plants for their nematicidal and fungicidal properties against Meloidogyne incognita and Fusarium oxysporum. Asian Journal of Experimental Science 16(1&2): 21-28.
Siva, N.; S. Ganesan; N. Banumathy & Muthuchelian. (2008). Antifungal effect of leaf extract of some medicinal plants against Fusarium oxysporum causing wilt disease of Solanum melongena L. Ethnobotanical Leaflets 12: 156-163.
Subramaniyan, V. (2020). Therapeutic importance of caster seed oil. En: Nuts and seeds in health and disease prevention. Academic Press, London. pp.485-495.
Thomas, D.S. & A.H. Rose. (1979). Inhibitory effect of ethanol on growth and solute accumulation by Saccharomyces cerevisiae as affected by plasma-membrane lipid composition. Archives of Microbiology 122(1): 49-55. https://doi.org/10.1007/BF00408045
Tripathi, P. & N.K. Dubey. (2004). Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables. Postharvest biology and Technology 32(3 235-245. https://doi.org/10.1016/j.postharvbio.2003.11.005
USDA National Organic Program. (2001). The national list of allowed and prohibited substances. United States Code of Federal Regulations 7: 205-601.
Valerio, F.; A.N.H. Cano & M.E. Suárez. (2022). Etnobotánica de plantas tóxicas en el partido de Vicente López (Buenos Aires, Argentina). Bonplandia 31(1): 5-26. http://dx.doi.org/10.30972/bon.3115803
Wittstock, U. & J. Gershenzon. (2002). Constitutive plant toxins and their role in defense against herbivores and pathogens. Current Opinion in Plant Biology 5(4): 300-307. https://doi.org/10.1016/s1369-5266(02)00264-9
Worbs, S.; K. Köhler; D. Pauly; M.A. Avondet; M. Schaer; M.B. Dorner & B.G. Dorner. (2011). Ricinus communis intoxications in human and veterinary medicine - A summary of real cases. Toxins 3: 1332-1372. https://doi.org/10.3390/toxins3101332
Woudenberg, J.H.C.; J.Z. Groenewald; M. Binder & P.W. Crous. (2013). Alternaria redefined. Studies in Mycology 75:171-212. https://doi.org/10.3114/sim0015
Zaker, M. (2016). Natural plant products as eco-friendly fungicides for plant diseases control-A review. The Agriculturists 14(1): 134-141. https://doi.org/10.3329/agric.v14i1.29111
Notas de autor
eugesuarez78@gmail.com

