Identificación de alelos de gluteninas y gliadinas en harinas de trigo entero (Triticum aestivum L.) y su relación con la calidad panadera
Revista de la Facultad de Agronomía
Universidad Nacional de La Plata, Argentina
ISSN: 1669-9513
Periodicidad: Semestral
vol. 121, núm. 2, 2022
Recepción: 01/08/22
Aprobación: 08 Septiembre 2022
Resumen: Las variantes alélicas de gluteninas de alto (GAPM), bajo peso molecular (GBPM) y las gliadinas influencian fuerza y extensibilidad en las masas determinando el uso industrial del trigo (Triticum aestivum L.). El objetivo del estudio fue identificar los alelos de gluteninas y gliadinas y determinar su relación con la calidad panadera en las variedades Cal Blanco F2011, Matchett F2011 y RSM-Norman F2008 cosechadas en otoño-inverno 2014-2016. Cada muestra (3 kg) se procesó por triplicado. El fraccionamiento de proteínas fue en geles verticales (20 x 23 cm) mediante SDS-PAGE. Se identificaron GAPM y GBPM, se compararon con proteínas reportadas por distintos autores y se definió el probable uso final de cada variedad. Para el locus Glu-1 se encontró en: Cal Blanco F2011 y Matchett F2011 los alelos 1; 17+18; 5+10; y para RSM-Norman F2008 2*; 7+9; 5+10 todos relacionadas con buena fuerza y extensibilidad, a excepción del alelo 7+9. Para el locus Glu-3 en: Cal Blanco F2011 los alelos b, g y c; Matchett F2011 d, h y b; y RSM-Norman F2008 c, g y b. Finalmente para el locus Gli-B1 de ω-gliadinas en: Cal Blanco F2011 el alelo f; Matchett F2011 d; y RSM-Norman F2008 f. La identificación de los alelos, el análisis de distribución y la comparación en la literatura nos permitió clasificar a las variedades: RSM-Norman F2008 calidad moderada-alta; Matchett F2011 calidad alta y Cal Blanco F2011 calidad alta. Por lo tanto se presumen variedades con gluten fuerte. La variedad Cal Blanco F2011 podría emplearse para mejorar masas.
Palabras clave: Triticum aestivum L, fuerza y extensibilidad.
Abstract: Allelic variants of glutenins of high (GAPM), low molecular weight (GBPM) and gliadins influence strength and extensibility in doughs determining the industrial use of wheat (Triticum aestivum L.). The objective of the study was to identify the glutenin and gliadin alleles and determine their relationship with baking quality in the Cal Blanco F2011, Matchett F2011 and RSM-Norman F2008 varieties harvested in autumn-winter 2014-2016. Each sample (3 kg) was processed in triplicate. Protein fractionation was performed on vertical gels (20 x 23 cm) by SDS-PAGE. GAPM and GBPM were identified, compared with proteins reported by different authors and the probable final use of each variety was defined. For the Glu-1 locus, alleles were found in: Cal Blanco F2011 and Matchett F2011 1, 17+18, 5+10; and for RSM-Norman F2008 2*, 7+9, 5+10 all related to good strength and extensibility, except for the 7+9 allele. For the Glu-3 locus in: Cal Blanco F2011 the b, g and . alleles; Matchett F2011 d, h y .; and RSM-Norman F2008 c, g and .. Finally, for the Gli-B1 locus of ω-gliadins in: Cal Blanco F2011 the allele .; Matchett F2011 .; and RSM-Norman F2008 .. The identification of the alleles, the distribution analysis and the comparison in the literature allowed us to classify the varieties: RSM-Norman F2008 moderate-high quality; Matchett F2011 high quality and Cal Blanco F2011 high quality. Therefore varieties with strong gluten are presumed. The Cal Blanco F2011 variety could be used to improve dough.
Keywords: Triticum aestivum L, strength and extensibility, alleles.
Introducción
El trigo (Triticum aestivum L.) es el principal cereal cultivado en el mundo, proporciona una quinta parte del aporte calórico total a la población mundial y es base para elaborar diversos productos industrializados. En México, ocupa un lugar importante, después del maíz (Zea mays) y frijol (Phaseolus vulgaris) y está entre los 10 productos agroalimentarios estratégicos. Su demanda para los principales usos industriales (pan y galletas) presenta incremento (SAGARPA, 2015). En el trigo panificable, se buscan incrementos en producción, rentabilidad y mejores oportunidades en el mercado, mediante prácticas agronómicas y nuevas tecnologías, como genotipificaciones (SAGARPA, 2015). Los diversos usos del trigo dependen de sus propiedades reológicas, como cohesividad, viscosidad y elasticidad que confieren a la masa, fuerza y extensibilidad (Liang et al., 2015; Gao et al., 2016; Li et al., 2016). Estas propiedades son únicas del trigo y dependen de la cantidad y calidad de las proteínas del grano (gliadinas, gluteninas), mismas que forman el gluten (Peña et al., 2002; Martínez et al., 2014; Chaudhary et al., 2016). Las gluteninas, son proteínas poliméricas relacionadas con fuerza y extensibilidad de la masa, las gliadinas son proteínas monoméricas, responsables de la viscoelasticidad (Islas et al., 2005; Gao et al., 2016). Por lo tanto, ambos grupos proteicos son componentes cruciales para la calidad y destino industrial de este cereal (Ibrahim, 2013; Wang et al., 2016; Li et al., 2016).
Por su movilidad electroforética, las gluteninas se clasifican en subunidades de alto (GAPM) (80-120 kDa) y bajo peso molecular (GBPM) (30-50 kDa) (Payne y Corfield 1979; Dong et al., 2010). Cerca del 20 % de la fracción total de gluteninas son GAPM y el resto son GBPM (Payne y Lawrence, 1983). Las GAPM (loci Glu-1), están codificadas por los loci Glu-A1, Glu-B1 y Glu-D1, localizados en los brazos largos del grupo 1 de los cromosomas 1A, 1B y 1D, respectivamente (Shewry et al., 2003; Li et al., 2016; Gao et al., 2016). Las GBPM (loci Glu-3), se relacionan con la fuerza de la masa, son altamente polimórficas y están codificadas por los loci Glu-A3, Glu-B3 y Glu-D3 de los brazos cortos del mismo grupo 1 de cromosomas. Estos loci se encuentran ligados al locus Gli-., que codifica para gliadinas (Shewry y Halford, 2002; Tanaka et al., 2005; Wang et al., 2016).
Se han identificado más de 20 alelos con diferentes efectos sobre la calidad industrial en trigos hexaploides, de los cuales, seis son de Glu-A3, nueve de Glu-B3 y cinco de Glu-D3. Los diferentes loci Glu-3 y sus efectos sobre la calidad industrial del trigo, se han incluido recientemente en la clasificación del trigo panadero. El alelo Glu-B3i ha sido correlacionado con una calidad panadera superior, mientras que otros alelos, como el Glu-A3e, se relacionan con efectos negativos, por lo que los alelos de Glu-A3 y Glu-B3 son señalados con mayor relevancia dentro de la calidad industrial. Así, en el mejoramiento del trigo moderno, se realizan selecciones de variaciones genéticas de los materiales vegetativos en base a la composición de la variabilidad de gluteninas (Wang et al., 2016). Las gliadinas están codificadas por grandes familias multigénicas (α-, β-, γ- y ω-) por lo que es difícil establecer correlaciones entre estas proteínas y las propiedades tecnológicas. Debido a que los efectos atribuidos a una gliadina, pueden ser generados por otros grupos asociados de gliadinas o por GBPM. Sin embargo, se ha demostrado que al añadir subgrupos de gliadinas a la masa, existe una disminución en la fuerza de la masa con los efectos relativos de debilitamiento (Chaudhary et al., 2016). La propiedad viscoelástica de la masa, es el resultado de la interacción entre polímeros de gluteninas con gliadinas monoméricas. Hay que señalar que tanto los puentes disulfuro, incluyendo enlaces disulfúricos intermoleculares e intramoleculares, como los enlaces triptófano, no sólo provienen de GAPM sino también provienen de gliadinas y GBPM. El resultado de su combinación, afecta las propiedades de la masa (Li et al., 2016; Gao et al., 2016). Payne (1987) y Gupta y Shepherd (1990) propusieron puntajes y clases de calidad para los loci Glu-1 y loci Glu-3, respectivamente. Mismos, que han sido utilizados por diversos programas de selección y mejoramiento de trigo, en donde determinados alelos de GAPM y GBPM y principalmente sus combinaciones, se relacionan con trigos de alta calidad bajo la consideración de diversas pruebas de calidad, como el índice de Zeleny, por lo que han sido utilizadas para calificar diversos materiales por diversos autores (Rasheed et al., 2012; Bellil et al., 2014).
Las variedades de trigo deben poseer una calidad final adecuada, para ser liberadas y aceptadas por productores, molineros y finalmente, por consumidores. En los programas de mejoramiento, la caracterización de GAPM, GBPM y gliadinas, es una herramienta complementaria que permite combinar el contenido y calidad de las proteínas de manera más eficaz. Lo que permite a los mejoradores acelerar la adaptación de nuevas variedades, para satisfacer requisitos específicos de calidad para los diferentes destinos industriales de este cereal, principalmente para la industria panadera. Así, el trigo nacional podría empezar a competir en precio y calidad industrial, con el importado (Peña et al., 2002; Battenfield et al., 2016). El objetivo de este estudio, fue identificar y analizar la distribución de los alelos de GAPM, GBPM y gliadinas, relacionados con calidad de panificación en las variedades de trigo Cal Blanco F2011, Matchett F2011 y RSM-Norman F2008 actualmente incluidas en estudios agronómicos.
METODOLOGÍA
MATERIAL VEGETAL
Las variedades de trigo Cal Blanco F2011, RSM-Norman F2008 y Matchett F2011, se cultivaron en otoño-invierno de 2014 a 2016, las donó el programa de mejoramiento genético de trigo de la empresa Resource Seeds International.
Extracción de proteínas y SDS-PAGE
La composición de subunidades de gluteninas y gliadinas se determinó en el Laboratorio de Calidad de Trigo del CIMMYT, El Batán, México. La extracción de proteínas y la electroforesis SDS-PAGE se realizaron mediante el método de Singh et al. (1991) con modificaciones de Peña et al. (2004). La harina integral se obtuvo en un molino de laboratorio (Nixtamatic NCM1, INMEZA, México). A 20 mg de la harina se añadieron 0.75 mL de propanol 50 %, para incubar en un Termomixer Comfort (Eppendorf, USA) a 1,400 rpm, 30 min, 65 °C y se centrifugaron a 10,000 rpm, 2 min. Del sobrenadante se obtuvieron gliadinas y del precipitado gluteninas. El sobrenadante se evaporó 4 a 5 h, a 65 ºC. Posteriormente, se agregaron 0.3 mL de la Solución de extracción pH 8.0 [(SDS 2 % (Merck), glicerol 40 % (Sigma), azul de bromofenol 0.02 % (Sigma)] y se incubó nuevamente en Termomixer Comfort a 5 min, 90 ºC para centrifugarse a 13,000 rpm, 5 min para homogenizar los reactivos. Para la extracción de gluteninas, al precipitado obtenido del primer paso, se le agregó 0.1 mL de Ditiotreitol (Sigma) 1.5 % fresco y se incubó en un Termomixer 65 ºC, 30 min para centrifugarse por 13,000 rpm, 5 min. Al precipitado obtenido, se le agregaron 0.1 mL de una solución fresca de Vinilpiridina (Sigma) 1.4 %, para incubarse en agitación nuevamente por 15 min y centrifugarse. Se tomaron 0.180 mL del sobrenadante y se mezcló 1:1 con una solución amortiguadora a pH 6.8 [(SDS 2 % (Merck), glicerol 40 % (Sigma), azul de bromofenol 0.02 % (Sigma)]. En las condiciones de agitación mencionadas se mantuvo por 5 min a 90 °C y se centrifugó 5 min a 10,000 rpm.
El fraccionamiento de proteínas por SDS-PAGE, se logró en geles verticales (20 X 23 cm) de 15 y 4.8 %, de resolución y fracción concentradora, respectivamente, y con separadores 1 mm en un sistema tampón Tris-HCl-SDS discontinuo a 12 mA, 20 h. Previo al teñido, los geles se sumergieron en ácido tricloroacético 12 %, 5 min para ser teñidos con azul de bromofenol (4 h). El desteñido se llevó a cabo en agua destilada por 24 h. Se analizaron e identificaron visualmente los alelos (Singh et al., 1991; Peña et al., 2004).
Nomenclatura
Para identificar los alelos, se emplearon las nomenclaturas de Payne y Lawrence (1983) para GAPM y para GBPM las de Jackson et al. (1996) y Branlard et al. (2003). Para la identificación de las bandas en los geles de poliacrilamida en condiciones disociantes (SDS-PAGE), se utilizaron las variedades ampliamente estudiadas: Pavon 76; Opata M85 y Pitic 62 donadas por CIMMYT, como testigos.
La extracción de ADN se realizó mediante kit Plant DNAzol Invitrogen. con ligeras modificaciones. La cantidad y calidad del ADN se determinó por espectrofotometría con el equipo GENESYS™ 10S UV-Vis, se verificó su integridad en geles de agarosa al 1 %.
La PCR se realizó en un termociclador Techne, las condiciones de reacción y el primer son los empleados por Izadi et al. (2012). El producto de PCR se corrió en geles de agarosa al 2 %. Para determinar el peso molecular de las bandas se empleó el marcador promega de 1000 pbs.
Análisis Estadístico
En el experimental de campo se utilizó un diseño experimental de bloques completos al azar con tres repeticiones. Las muestras de cada genotipo, se obtuvieron aleatoriamente de tres surcos para una compuesta de 3 kg y se procesaron por triplicado. Para la identificación de los alelos de gliadinas y gluteninas, relacionados con calidad panadera se consideró la presencia de los mismos, en geles de electroforesis SDS-PAGE. Para analizar la distribución de los alelos, se examinó la diversidad genética de cada locus mediante la fórmula de Nei (1973), H = 1-Ʃ Pi.. Donde H, es el índice de variación genética de Nei y Pi, la frecuencia de un alelo en particular en un locus. La frecuencia alélica (0-100 %), se estimó al sumar las frecuencias de los alelos en los genotipos individuales y se dividió entre el total de genotipos estudiados.
RESULTADOS
En las tres variedades se identificaron 14 alelos diferentes: 1 y 2* para Glu-A1, 17+18 y 7+9 en Glu-B1 y para Glu-D1 5+10, correspondientes a GAPM. En las GBPM se encontraron para Glu-A3, b, c y d, en Glu-B3, g y ., y para Glu-D3, c y .. Finalmente, para gliadinas en Gli-B1, se visualizaron los alelos . y d. De manera general los tres materiales analizados mostraron patrones genéticos diferentes, aunque de forma individual en algunos alelos son iguales tal como se observa en la Figura 1.
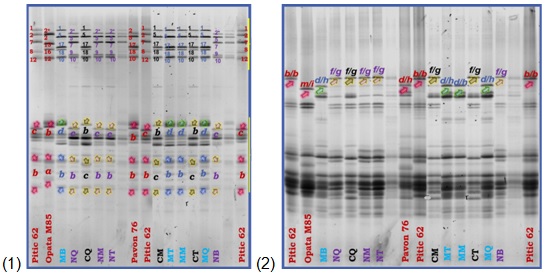
Figura 1.
Patrones genéticos de los loci Glu-1, Glu-3 y Gli-1 en las variedades Cal Blanco F2011, RSM-Norman F2008 y Matchett F2011. Referencias:(1) Gel loci Glu-1 y Glu-3 en orden decendente. (2) Gel loci Gli-1. MB, MT, MM, MQ = Matchett F2011; NQ, NM, NT, NB = RSM-Norman F2008; CQ, CM, CT = Cal Blanco F2011 en distintas repeticiones.
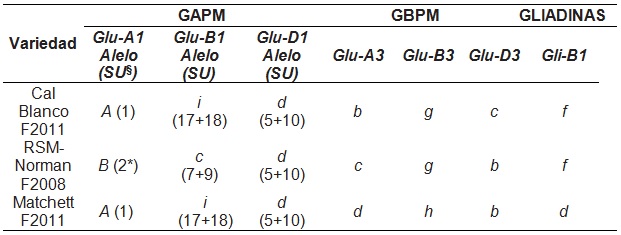
Respecto a GAPM como se observa en la tabla 1, de los cinco alelos encontrados, el alelo más frecuente fue la subunidad 5+10 del locus Glu-D1, presente en las tres variedades. La diversidad alélica y la distribución genética observada dentro de los materiales indica que el alelo más frecuente, fue el de la subunidad 1 (66.6 %), del locus GluA1. En cuanto al locus GluB1, la distribución alélica fue más elevada para la subunidad 17+18 (66.6 %), en comparación con el alelo 7+9 (33.3 %). Para las subunidades de las GBPM, los alelos con una mayor frecuencia fueron . y b (66.6 %), de los locus Glu-B3 y Glu-D3, respectivamente. Sin embargo, los alelos b, c y . del locus GluA3, mostraron una distribución homogénea en sus frecuencias (33.3 %) respectivamente, al estar cada uno presente entre las variedades estudiadas. Así como para las gliadinas, el alelo ligado con mayor frecuencia fue el . (66.6 %).
La variación genética por los índices H calculados de acuerdo al método de Nei (1973) mostró una media de 0.41, dentro de un rango de 0.0-0.67, entre las variedades estudiadas. El locus que no presentó variación entre sus genes fue el Glu-D1, ya que el alelo . (5+10), estuvo presente en todas los materiales (0.0). El locus Glu-A3, de las GBPM fue reportado con la variación más alta (0.67), ya que este Loci, presentó un alelo diferente en cada una de las variedades. El coeficiente de variación genética para el loci Glu-3, fue de 0.52, en comparación con el loci Glu-1 de 0.15. Por lo que se sugiere, que en las tres variedades del presente estudio, los alelos del locus Glu-3 se encontraron mayormente distribuidos y que presentaron distribuciones bimodales o trimodales, a diferencia de los alelos del loci Glu-1, por la presencia de la subunidad 5+10 (Glu-D1d).
Los resultados de la PCR como se observa en la Figura 2, confirmaron la presencia del alelo Bx7 en la variedad RSM-Norman F2008 ya antes identificado identificación por SDS-PAGE.
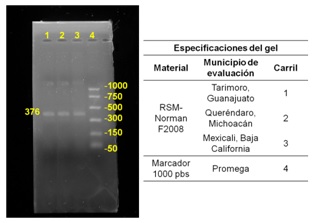
Figura 2
Gel de agarosa al 20% de la variedad RSMNorman F2008 evaluada en tres Localidades de México
DISCUSIÓN
Si partimos de que al conocer la combinación de los alelos de gluteninas y gliadinas se puede definir la fuerza y extensibilidad de la masa, por lo tanto su probable uso industrial de los presentes materiales. Entonces, tanto de manera individual como en combinación, afectan las propiedades tecnológicas de la masa (Li et al., 2016; Gao et al., 2016).
La diversidad alélica observada dentro de los materiales mostró, respecto al locus GluA1, la ausencia del alelo nulo en las variedades estudiadas, lo cual, se considera como una fortaleza en cualquier material pues a menudo es relacionado con baja calidad panadera (Izadi et al., 2010). Respecto al alelo 5+10 ocasionalmente está presente en variedades desarrolladas en determinadas localidades en México (Martínez et al., 2014). Sin embargo, es citado por diversos autores como indicador de calidad panadera (Izadi et al., 2010; Martínez et al., 2012; Bellil et al., 2014; Martínez et al., 2014).
En la relación de los alelos con los destinos industriales considerando la puntuación de calidad propuesta por Payne (1987) y Gupta y Shepherd (1990), una fortaleza de las tres variedades, se relaciona a la presencia de los alelos 2* y 1. Estos, han sido mencionados por diversos autores como los mejores para la extensibilidad de la masa. Además dichos alelos, al igual que las subunidades 5+10 y 17+18, tienen efectos similares al promover mayor fuerza en las masas (Cornish et al., 2001; Branlard et al., 2003; Gao et al., 2016; Li et al., 2016). Ibrahim (2013) y Gao et al. (2016), atañen a todos los alelos antes mencionados buena calidad (2*, 1, 5+10 y 17+18), aunque mencionan a 7+9 con pobre calidad, lo que difiere de lo reportado por Martínez et al. (2012) con 7+9 y 5+10, que los relacionan para gluten fuerte. En adición al alelo 7+9, al encontrarse específicamente el “7” en la variedad RSM-Norman F2008 según la figura 2 y considerando si su presencia es benéfica o no, podemos de cierta forma coincidir en que tiene efecto negativo su presencia en las masas ya que Calixto et al. (2021) reporta que en la prueba de panificación realizada a esta variedad es la que menor volumen de pan tuvo respecto a las otras dos variedades y el testigo que se empleó, además es la única variedad que lo presento.
Para GBPM otros autores propusieron a los locus Glu-A3 . Glu-B3, como importantes para la calidad, principalmente al alelo . (Glu-B3h) relacionado con calidad panadera y como presunto mejorador de la calidad de la masa de trigo, con efecto importante en la fuerza y extensibilidad de esta, como también a los alelos . y . del locus Glu-A3 y el alelo g, de Glu-B3 (Jin et al., 2012; Zhang et al., 2013; Wang et al., 2016). Zhang et al. (2013), propusieron que el locus Glu-D3 no tiene efectos significativos en dicha calidad.
Las combinaciones de Glu-1, dentro de los patrones genéticos visualizados en Cal Blanco F2011 y Matchet F2011 (1, 17+18, 5+10), han sido reportadas con una puntuación de calidad de 10, lo que presume a estos materiales con una calidad alta. La cual, es mayor a la puntuación de la combinación de ese mismo loci en RSM-Norman F2008 (Glu-A1b, Glu-B1c, Glu-D1d) de 9 (Martínez et al., 2012). En cuanto a las variantes alélicas de las GBPM, los patrones genéticos mostraron combinaciones semejantes a las reportadas por otros autores como Izadi et al. (2010) y Bellil et al. (2014) con una calidad de la masa de alta a moderada. La variedad Cal Blanco F2011 con Glu-A3b, Glu-B3g . Glu-D3c, se propone con una calidad moderada de la masa, ya que la presencia de los Alelos Glu-B3g y Glu-B3c, que se señalan con calidad moderada, como también se sugiere para la combinación en RSM-Norman F2008 (GluA3c, Glu-B3g, Glu-D3b). Finalmente, Marchet F2011 mostró la combinación Glu-A3d, Glu-B3h, Glu-D3b, de la cual, todos los alelos han sido citados con una alta calidad o de gran fuerza para la masa, especialmente, el alelo Glu-B3h, que se relaciona como un mejorador en la calidad del trigo (Izadi et al., 2010; Zhang et al., 2013; Jin et al., 2012; Gulia y Khatkar, 2014; Bellil et al., 2014; Gao et al., 2016).
En cuanto a las Puntuaciones de Calidad de Payne (1987) y Gupta y Shepherd (1990), las variantes alélicas de Glu-1, obtuvieron un puntaje de 9 al 10, para las tres variedades. Las variantes de las GBPM de Glu-3, obtuvieron puntajes de calidad moderada para RSM-Norman F2008 y Cal Blanco F2011, y de alta para Marchet F2011, con una alta frecuencia alélica para la subunidad Glu-D1d, junto con un una distribución genética homogénea dentro de esta población, al estar presente en las tres variedades. Por lo que los materiales estudiados, pueden clasificarse con una calidad panadera de moderada a alta, en base a la distribución alélica de sus GAPM y GBPM.
Por lo tanto, de acuerdo a la clasificación de los trigos en México por tipo de gluten (CANIMOLT, 2014) y los resultados del presente trabajo, al menos dos materiales estudiados podrían colocarse dentro del Grupo 1, para trigos de gluten fuerte y extensible (muy elástico) para uso dentro de la industria mecanizada, elaboración de pan de caja y como correctores de trigos con fuerza inferior según la Figura 3.

Figura 3
Esquema compuesto de los alelos contenidos en harinas de grano entero de trigo de la variedades Cal Blanco F2011 RSMNorman F2008 y Matchett F2011 contra harinas comerciales los Gallos una integral y una refinada en una prueba de panificación Testigos Harina Refinada los Gallos HGRSA Harina Integral los Gallos HGISA Harinas de grano entero de trigo de las variedades Cal Blanco F2011 HCB Matchett F2011 HM RSMNorman F2008 HN
Figura 3. Esquema compuesto de los alelos contenidos en harinas de grano entero de trigo de la variedades Cal Blanco F2011, RSM-Norman F2008 y Matchett F2011 contra harinas comerciales los Gallos (una integral y una refinada) en una prueba de panificación. Testigos: Harina Refinada los Gallos (HGRSA); Harina Integral los Gallos (HGISA). Harinas de grano entero de trigo de las variedades: Cal Blanco F2011 (HCB); Matchett F2011 (HM); RSM-Norman F2008 (HN).
Calixto et al. (2021) observaron que las tres harinas integrales experimentales resultaron ser competitivas en comparación con las harinas comerciales. Destacan que la variedad Cal Blanco F-2011 dio mejores resultados según las pruebas bromatológicas, mixograma, prueba de Kieffer Rig, prueba de panificación y fermentación. La variedad Matchett F2011 la secundo, sobre todo en la prueba de Kieffer Rig. Si consideramos tanto la presencia de alelos ligados a calidad y los resultados de las pruebas antes mencionadas podremos tener un mejor panorama de cada material.
Conclusiones
La identificación de los alelos de GAPM, GBPM y gliadinas, junto a su análisis de distribución y la comparación en la literatura nos permitió clasificar a las variedades de la siguiente manera: RSM-Norman F2008 con una calidad moderada-alta; Matchett F2011 con calidad alta y Cal Blanco F2011 con excelente calidad.
De acuerdo a los datos obtenidos y recopilados se presume que las variedades presentan gluten fuerte.
La variedad Cal Blanco F2011 podría emplearse para mejorar masas.
Se recomienda, solo como confirmación, obtener harinas refinadas de cada variedad y evaluar su comportamiento en la prueba de panificación. Sin embargo los autores consideran que: la calidad de la variedad Matchett F2011 es competitiva o superior; la variedad RSM-Norman F2008 competitiva y la variedad Cal Blanco F2011 superior, respecto a las harinas comerciales los gallos.
Agradecimientos
A la Empresa Resource Seeds International, a CIMMYT y CONACYT por su apoyo y facilidades brindadas para realizar este trabajo. A la Dra. Marta Lidia Salgado Sinclan por las facilidades otorgadas para realizar los geles de PCR.
Bibliografía
Battenfield, S.D.; C. Guzmán; R.C. Gaynor; R.P. Singh; R.J. Peña; S. Dreisigacker; A.K. Fritz & A.J. Poland (2016). Genomic Selection for Processing and End-Use Quality Traits in the CIMMYT Spring Bread Wheat Breeding Program. The plant genome 9: 12. http://dx.doi.org/10.3835/plantgenome2016.01.0005
Bellil, I.; O. Hamdi & D. Khelifi (2014). Allelic variation in Glu-1 and Glu-3 loci of bread wheat (Triticum aestivum ssp. aestivum L. em. Thell.) germplasm cultivated in algeria. Cereal Research Communication 42: 648-657. http://dx.doi.org/10.1556/CRC.2014.0004
Branlard, G.; M. Dardevet; N. Amiour & G. Igrejas (2003). Allelic diversity of HMW and LMW glutenin subunits and omega gliadins in French bread wheat (Triticum aestivum L.). Genetics Research Crop Evolution 50: 669-679.
Calixto, M.J.J.; D.L.M. Pinzón; J.J. Castillón; S. Rajaram; M. M. Albarrán & A.R.R. Islas. (2021). Calidad panadera de harinas de trigo entero mediante pruebas convencionales y una prueba no convencional. Revista de la Facultad de Agronomía 120(1):1-10.
Cámara Nacional de la Industria Molinera de Trigo (CANIMOLT) (2014). Reporte Estadístico al 2014, Sinnergia Diseño Ayuntamiento 7-2ª Col. Cd. Adolfo López Mateos, Edo. de México, México, pp: 98-100.
Chaudhary, N.; P. Dangi, & S.B. Khatkar. 2016. Effect of Gliadin Addition on Dough Mixing Properties of Wheat Varieties. International Journal of Innovative Research in Science Engineering and Technology 5: 1942-1947. http://dx.doi.org/10.15680/IJIRSET.2015.0506251
Cornish, G.; B. Bekes; F.H.M. Allen & J.D. Martin. (2001). Flour proteins link to quality traits in an Australian doubled haploid wheat population. Australian Journal Agricultural Research 52: 1339-1348.
Dong, L.; X. Zhang; D. Liu; H. Fan; J. Sun; Z. Zhang; H. Qin; B. Li; S. Hao; Z. Li; D. Wang; A. Zhang & H.Q. Ling. (2010). New insights into the organization, recombination, expression and functional mechanism of low molecular weight glutenin subunit genes in bread wheat. PLoS ONE 5: e13548. http://dx.doi.org/10.1371/journal.pone.0013548
Gao, X.; T.J. Liu; L. Yu; Y. F. Li & X. Li. (2016). Influence of high-molecular-weight glutenin subunit composition at Glu-B1 locus on secondary and micro structures of gluten in wheat (Triticum aestivum L.). Food Chemistry 197: 1184-1190. http://dx.doi.org/10.1016/j.foodchem.2015.11.085
Gulia, N. & S.B. Khatkar. (2014). Quantitative and qualitative assessment of wheat gluten proteins and their contribution to instant noodle quality. International Journal of Food Properties 18: 1648-1663. http://dx.doi.org/10.1080/10942912.2013.805765
Gupta, R.B. & W.K. Shepherd. (1990). Two-step one-dimensional SDS-PAGE analysis of LMW subunits of glutelin *1.Variation and genetic control of the subunits in hexaploid wheats. Theory Applied Genetics 80: 65-74.
Ibrahim, A.I. (2013). Gene stacking of high molecular weight glutenin genes in bread wheat using molecular markers. In: ASA CSSA SSSA International Annual Meetings (ed). Fundamental for life: Soil, Crop and Environmental Science. San Antonio, Texas, USA. pp: 25.
Islas, R.A.; F. MacRitchie; S. Gandikota & G. Hou. (2005). Relaciones de la composición proteínica y mediciones reológicas en masa con la calidad panadera de harinas de trigo. Revista Fitotecnia Mexicana 28: 243-251.
Izadi, A.; B. Yazdi; A.A: Shanejata & M. Mohammadi. (2010). Allelic variations in Glu-1and Glu-3 loci of historical and modern Iranian bread wheat (Triticum aestivum L.) cultivars. Journal Genetics 89: 193-199.
Jackson, E.; A.M. Morel; H.T. Sontag-Strohm; G. Branlard; E.V. Metakovsky & R. Redaelli. (1996). Proposal for combining the classification systems of alleles of Gli-1 and Glu-3 loci in bread wheat (Triticum aestivum L.). Journal Genetic and Breed 50: 321-336.
Jin, H.; Y. Zhang; G. Li; P. Mu; Z. Fan; X. Xia & Z. He. (2012). Effects of allelic variation of HMW-GS and LMW-GS on mixograph properties and Chinese noodle and steamed bread qualities in a set of Aroona near-isogenic wheat lines. Journal of Cereal Science 57: 146-152. http://dx.doi.org/10.1016/j.jcs.2012.10.011
Li, X.; T. Liu; L. Song; H. Zhang; L. Li & X. Gao. (2016). Influence of high-molecular-weight glutenin subunit composition at Glu-A1 and Glu-D1 loci on secondary and micro structures of gluten in wheat (Triticum aestivum L.). Food Chemistry 213: 728-734. http://dx.doi.org/10.1016/j.foodchem.2016.07.043
Liang, X.; S. Zhen; C. Han; C. Wang; X. Li; W. Ma & Y. Yan. (2015). Molecular characterization and marker development for hexaploid wheat-specific HMW glutenin subunit 1By18 gene. Molecular Breed 35: 221. http://dx.doi.org/10.1007/s11032-015-0406-2
Martínez, C.E.; E.R. Espitia; H.E.M. Villaseñor & R.J.B. Peña (2012). Contribución de los loci Glu-B1, Glu-D1 y Glu-B3 a la calidad de la masa del trigo harinero. Revista Fitotecnia Mexicana 35: 135-142.
Martínez, C.E.; R. Espitia; H.E.M. Villaseñor; R.S.R. Hortelano; M.F.G. Rodríguez & R.J.B. Peña (2014). La calidad industrial de la masa y su relación con diferentes loci de gluteninas en trigo harinero (Triticum aestivum L.). Agrociencia 48: 403-411.
Nei, M. (1973). Analysis of gene diversity in subdivided populations. Proc. National Academy of Sciences of the United States of America 70: 3321-3323.
Payne, P.I. (1987). Genetics of wheat storage proteins and the effect of allelic variation on breadmaking quality. Annu. Rev. of Plant Physiology 38:141-153.
Payne, P.I. & O.K. Corfield. (1979). Subunit composition of wheat glutenin proteins, isolated by gel filtration in a dissociating medium. Planta 145: 83-88.
Payne, P.I.; & J.G. Lawrence. (1983). Catalogue of alleles for the complex loci Glu-A1, Glu-B1 and Glu-D1, which code for high molecular weight subunits of glutenin in hexaploid wheat. Cereal Research Communications 11: 29-35.
Peña, R.J.; H.S. González & F. Cervantes. (2004). Relationship between Glu-D1.GluB-3 allelic combinations and breadmaking quality-related parameters commonly used in wheat breeding. In: Masci, S., and D. Lafiandra (eds). Proceedings of the 8th International Gluten Workshop. Viterbo, Italy. pp: 156-157.
Peña, B.R.J.; R. Trethowan; W.H. Pfeiffer & M.V. Ginkel. (2002). Quality improvement in wheat. Compositional, genetic, and environmental factors. Journal of Crop Production 5: 1–37.
Rasheed, A.; T. Safdar; A. Gul-Kazi; T. Mahmood; Z. Akram & A. Mujeeb-Kazi. (2012). Characterization of HMW-GS and evaluation of their diversity in morphologically elite synthetic hexploid wheats. Breeding Science 62: 365-370. http://dx.doi.org/10.1270/jsbbs.62.365
Shewry, P.R. & N.G. Halford. (2002). Cereal seed storage proteins: structures, properties and role in gran utilization. Journal of Experimental Botany 53: 947-958.
Shewry, P.R.; N.G. Halford & D. Lafiandra. (2003). Genetics of wheat gluten proteins. Advances in Genetics 49: 111-184.
Secretaría de Agricultura y Desarrollo Rural (SAGARPA) (2015). 3er Informe de labores 2014-2015, Ed. Grupo Gerzec, S. A. de C. V. México, D. F., pp: 92-124.
Singh, N.K.; K.W. Shepherd & B.G. Cornish. (1991). A simplified SDS PAGE procedure for separating LMW subunits of glutenin. Journal of Cereal Science 14: 203-208.
Tanaka, H.; R. Shimizu & H. Tsujimoto. (2005). Genetical analysis of contribution of low molecular weight glutenin subunits to dough strength in common wheat (Triticum aestivum L.). Euphytica 141: 157–162. http://dx.doi.org/10.1007/s10681-005-6714-6
Wang, X.; R. Appels; X. Zhang; F. Bekes; K. Torok; S. Tomoskozi; D. Diepeveen; M. Wujum & S. Islam. (2016). Protein-transitions in and out of the dough matrix in wheat flour mixing. Food Chemistry 217: 542-551. http://dx.doi.org/10.1016/j.foodchem.2016.08.060
Zhang, X.; D. Liu; J. Zhang; W. Jiang; W. Yang; J. Sun; Y. Tong; D. Cui & A. Zhang. (2013). Novel insights into the composition, variation, organization and expression of the low-molecular-weight-glutenin subunit gene family in common wheat. Journal of Expperimental Botany 64: 2027-2040. http://dx.doi.org/10.1093/jxb/ert070

